Откуда в термодинамике берутся всякие «изо»?
Вопрос:
Мы начали изучать термодинамику, и сразу же пошли всякие «изо»: изотермический, изохорический и т.п. Я никак не могу понять: откуда они берутся и почему их так много?
Ответ:
Действительно, в термодинамике много всяких изопроцессов. Вот как раз это слово, «процесс», и главное для понимания всех этих «изо». Как вы знаете, в термодинамике рассматриваются не всякие процессы, а процессы в пространстве состояний. Что это такое? Для сравнения возьмем процессы, которые рассматривает механика. Это – процессы во времени. Положение тела характеризуется его координатами, а процессы (механические) – это изменение этих координат во времени. То есть в систему координат механики, можно сказать, включено время.
В термодинамике же рассматривается процессы в некоторой (фиксированной, поскольку масса её постоянна) порции идеального газа (назовем её газовым телом). Координаты этой порции в пространстве не интересуют термодинамику. Она рассматривает другие параметры – давление газа (а точнее – газового тела) p , его объем V и температура T. Но не их изменение во времени, а изменения этих параметров в их связи между собой: например, увеличили давление – как изменятся другие параметры (газового тела)? Другие примеры из физики: связь между собой механического напряжения и относительной деформации твердого тела (закон Гука). Изобразить такую связь можно на 2х-мерной диаграмме. Получается кривая. Но чтобы изобразить связь между 3-мя параметрами газового тела (p, V, T), потребуется уже 3х-мерная диаграмма (поскольку мы имеем функцию вида: p=f(V,T). Конкретный вид этой функции дает уравнение состояния идеального газа. Используя его, получим такую поверхность (см. рис.1)).
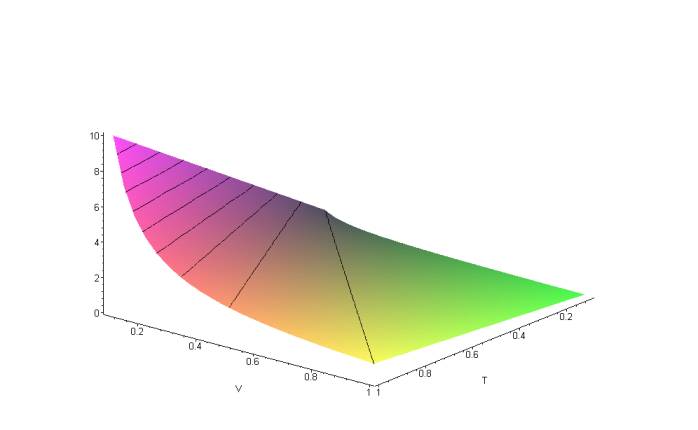
Рис.1. p-V-T диаграмма состояний идеального газового тела.
Но на этой поверхности изображено семейство всех (возможных) процессов в газовом теле. Конкретный процесс отображает любая линия на этой поверхности, поскольку она соединяет 2 состояния (отображаемые точками на этой поверхности). Как же из этой поверхности выделить процесс? Нужно добавить ещё какое-нибудь уравнение! Например, простейшее: p=p0, где p0=const. (Но не обязательно именно такое. Уравнение может быть любым! Например, вида P=k*T, где k=const.) Вот тогда и получится изобарический процесс. Он описывается уравнением: T= p0/n*V (где n – количество молей газа в газовом теле), а на диаграмме T-V отображается прямой линией. (Требуя постоянства других параметров газового тела, можно получить другие изопроцессы.)
Добавленное уравнение (p=p0) кажется искусственным, и это так и есть. Поскольку в природе таких связей не наблюдается (в отличие от уравнения состояния идеального газа). Но добиться выполнения условия p=p0 на практике можно – с помощью технического приспособления. Однако устройство такого приспособления термодинамику уже не интересует. Это – дело инженеров. Наиболее просто на практике получить выполнение условия V=V0 (где V0=const). Для этого достаточно поместить газовое тело в жесткий резервуар. Конечно, жесткий по меркам заданного давления (газа в нем).