В «джунглях» 2-ого
закона термодинамики или тайна энтропии
©
Копылов
Михаил
Часть 2
Абсолютный нуль
температуры. 3-ий закон термодинамики.
Адиабатический и изотермический процесс как особые процессы.
Петя: А ведь
получается, что постулирование (абсолютного) нуля температур (а точнее –
запрещение отрицательных (в абсолюте) температур!) губит физику (->
термодинамику)!
Ю.А.: Почему это?
Петя: Ведь,
во-первых, именно благодаря этому мы получаем нулевую энтропию. Потому что если
есть абсолютное отсутствие (внутреннего) движения, то есть и полная
(абсолютная) упорядоченность (которая и есть полное равновесие. И однородность
– исключенная в МУ (материальном универсуме). См. ДИАЛОГИ
О ДВУХ СИСТЕМАХ МИРА №2)
Во-вторых, (согласно
определению энтропии как приведенной теплоты: dS=dQ/T) при приближении к абсолютному 0, соответствующее
(элементарное) изменение энтропии
стремится не к 0, а к неопределенности {0/0}.
Как же быть?
Ю.А.: Проблему эту разрешает 3-ий закон термодинамики: при абсолютном 0 температуры S=0.
Отсюда следствие: при T=0 изотермический процесс является также и изоэнтропийным (=адиабатическим). В противном же случае (то есть при T>0):
dA= dU+dQ=> T*dS=Cv*dT+ p*dV
Оля: Но ведь это же следствие (про совпадение изотермического и изоэнтропийного процессов) вытекает и из этой формулировки! Поскольку при T=0 и dT=0 получаем p*dV=0. Откуда либо p=0 и dV=0. То есть любое сжатие газа не требует работы (поскольку p=0. Это и понятно, потому что (по МКТВ) при T=0 vср=0 => p=0)
Петя: Получается, значит, что вся коллизия ЗТд-2 - в несовпадении (при T>0) адиабатического и изотермического процесса!
То есть в существовании такой (странной) штуки, как адиабатический нагрев (или охлаждение). Отсюда и так называемая идеальная (обратимая?) тепловая машина (машина Карно) становится возможна.
Ю.А.: Но почему адиабатический процесс (наряду с изотермическим, правда. Который также присутствует в машине Карно) занимает особое место среди процессов? Почему говорят (как об идеале) о его совпадении в изотермическим процессом? И что он, адиабатический процесс, из себя представляет?
Петя: Как следует из традиционного понимания адиабаты, адиабатический нагрев – это сжатие … при одновременном охлаждении?
Но разве это не то же самое, что изотермическое сжатие? То есть каков критерий адиабатичности процесса? Он (критерий) явно калориметрический.
Оля: А может, это нагревание и сжатие одновременно? Ведь только в этом случае мы получим повышение температуры.
Петя: Но таких процессов – много, как же из них выбирают адиабатический?
Оля: Очень просто: по изменению энтропии dS=dQ/T.
Ю.А.: Но при таком определении dS оно равно 0 только в том
случае, если dQ=0 (или T=infinity) Значит, на самом деле dS – это что-то другое (нежели
чем приведенная теплота). То есть её существование говорит о том, что
реальная энергия, передаваемая газу при нагреве, меньше dQ на величину dQ’=T*dS …
Оля: … которая тем больше, чем больше температура. (а dS тем меньше, чем меньше температура – см. ЗТр-3) Кстати, при этом также больше и дисперсия скорости!
Петя: Поэтому на самом деле энергетический баланс таков:
dU=dA+ dQ- T*dS,
Тогда величина dQ- T*dS – это некая «преобразованная» теплота (после передачи). То есть имеет место некий «налог» на передачу энергии в форме теплоты. Почему и различаются процесс изотермический:
0= dA+ dQ- T*dS=>
T*dS= dA+ dQ
и адиабатный (=изоэнтропийный):
dU= dA+ dQ =>dU= dA
(поскольку критерий адиабатности dQ-T*dS=0 => dQ=T*dS)
То есть температура повышается, но без видимого потока теплоты в тело! Но как это понять?
Оля: На самом же деле, думаю, одновременно идет два равных и противоположных потока. А если быть еще точнее – потери теплоты за счет энтропии (-> энтропийного фактора) только компенсируются.)
Петя: Каким же образом (технически) осуществляется адиабатность? Очень просто: нужно сжимать тело, но при этом поместив его в теплоизолирующую оболочку.
Оля: Так ли? Ведь в случае теплоизоляции теплота в систему поступать совсем не будет.
Петя: Да, над этим стоит подумать.
Изотермический же процесс (сжатие, например) отличается тем, что он происходит при поддержании постоянной температуры (в термостате).
Оля: Есть, правда, и еще один критерий адиабатности.
Адиабатическим процессом традиционно считается (в частном случае) политропный процесс (процесс с постоянной дифференциальной теплоемкостью). Но не всякий, а при показателе политропы, равном Cp/Cv (то есть частный случай политропы). Но, во-первых, при чем здесь Cp?
Петя: А
во-вторых, почему неизотермическое
сжатие (некоторый частный случай его. Каковым является политропный процесс)
считается адиабатическим процессом?
Отображение необратимых
(и обратимых) процессов
Эквивалентность смешанности и необратимости процессов.
Оля: Если на термодинамических (фазовых) диаграммах необратимым
процессам «тесно», то что же всё-таки
изучает термодинамика?
Ю.А.: Термодинамика – это наука о квазистатических законах
газового тела (изначально).
То есть она изучает не привычную статику, а статику как бы в движении.
Петя: А почему бы, с учетом нового понимания энтропии, не попробовать изобразить необратимые процессы? Ведь это новое понимание, вроде бы, позволяет это сделать.
Вот на самом деле, как изобразится процесс нагрева (пусть адиабатного), но с учётом энтропии (-> энтропийного фактора)?
В виде
DU=dA+ dQ- T*dS?
На фазовой диаграмме этот процесс не изображаем, так как величина T*dS зависит от времени (длительности) процесса (установления равновесия).
(Или, может, dQ зависит от времени? (поскольку процесс теплообмена инертный) Нет, временем (передачи данного dQ) определяется T*dS.)
Проще рассмотреть случай (чистой теплоты):
DU= dQ- T*dS=> dQ= dU+T*dS= Cv*dT+T*dS
Оля: Так как же все таки отображать необратимые процессы? Нет ли какого-то аналога (необратимости) в физике?
Петя: Да это же гистерезис! И главный его момент – то, что в нем учтено течение времени (хотя бы по направлению). А 2-ое – что есть исходная (причинная) величина и результирующая. По аналогии эта пара величин (для передачи теплоты) – это dU и dQ. Значит, необратимость процессов (в термодинамике) мы увидим на диаграммах вида dU(dQ) (или просто U(Q))(рис.3).
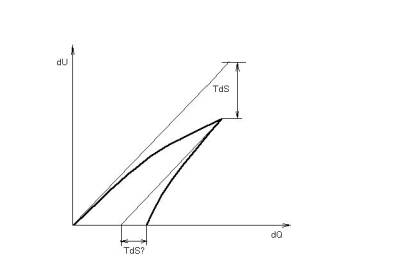
Рис.1.Неадиабатический нагрев и энтропийный эффект.
Оля: А как отображаются другие
(обратимые?) процессы?
Петя: Сжатие – это на самом деле
увеличение плотности (и давления. Если T=const).
Нагрев – это увеличение температуры (поэтому не существует изотермического нагрева. Равно как и изобарного (или изохорного?) (чистого) сжатия.)
Так что ничего интересного (в изображениях) нет.
Но вот изотермическое сжатие изображается так (рис.4):
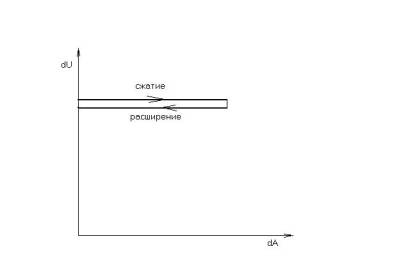
Рис.2.Изотермическое сжатие
Оля: А
адиабатический нагрев?
Петя: Понято! Адиабатический нагрев – это просто очень медленный нагрев (квазилинейный).
Так как для необратимости (=квазистатических диаграммах) важно не только направление времени, но и скорость процессов во времени. См. диаграмму нагружения твердого образца. Она ведь зависит от хода времени (скорости нагружения)).
Откуда (из медленности) и следует dQ->0.
Но это в единицу времени так. Потому что чем быстрее нагрев, тем больше проявляется энтропийный эффект (увеличивается энтропия. Которую обратно вернуть нельзя. Так как она всегда отнимает энергию. Как говорят (учебники), она всегда отрицательная. И лишь только в (квази)адиабатном процессе – приблизительно равна 0!)
Оля: Стало быть, можно себе представить и изотермический нагрев!
Петя: Как это?
Оля: Ведь при нагревании какая-то теплота (так или иначе) сообщается, а значит – растет внутренняя энергия. А если скорость нагрева увеличить? А потом еще больше? Да так (в пределе), что вся переданная теплота будет сразу же «съедаться» энтропийным фактором (кстати, поэтому энтропийный фактор надо сделать в расчете на единицу времени)
Вот и получится, что теплота передана…
Петя: … но нагрева (возрастания температуры) нет.
Оля: А изотермическое сжатие - это что, сжатие вместе с охлаждением?
Или просто очень медленное (см. адиабатический нагрев) сжатие? Такое, что …
Петя: … что?
Оля: Что давление успевает увеличиваться пропорционально плотности. Если же его (сжатие) делать быстрее, то плотность отстает, оттого и происходит доп. нагревание!
Петя: Однако нагрев при быстром сжатии затем сменяется (некоторым) охлаждением? И небольшим сбросом давления? Ввиду прихода в равновесие? То же и при энтропийном эффекте при быстром нагреве (?)
Оля: Да. Но данное обстоятельство может быть и не обнаружено, если сразу (до прихода в равновесие) за прямым запустить обратный процесс. Вот тогда мы и обнаружим факты необратимости. На самом же деле это факты не необратимости, а неравновесности (незавершенности уравновешивания).
Петя: И что же получается? Что адиабатический нагрев и изотермическое сжатие – это единственные обратимые процессы в термодинамике.
Оля: То есть и изобарический, и изохорный процесс – это необратимые?
А как же, например, изобарический нагрев? Ведь он же тоже является простым процессом.
То есть изобарический нагрев – это особый случай? Наряду с адиабатическим?
Получается, что это (изобарический нагрев) и есть адиабатический нагрев?
Ю.А.: Нет, не так. Даже при адиабатическом нагреве (если он чистый, то есть без расширения) давление тоже повышается. Причем пропорционально температуре (так как плотность при этом – константа. Однако если нагрев быстрый, то плотность не успевает приходить в равновесие.
Кстати: адиабатичность нагрева совершенно не мешает (не противопоставлена) его изобаричности.
Петя: Итак, особыми случаями процессов (всё-таки) являются только: адиабатичность (чистый нагрев «^2» – без (попутного) … охлаждения) и изотермичность (чистое сжатие «^2» – без попутного нагрева.
Оля: Ну а как изобразить изобарический нагрев?
Петя: Это всегда совмещение нагрева и расширения. Потому что при обычном (чистом =изохорическом!) нагреве давление всегда повышается. То есть (в данном случае) нужно (строить) 3х-мерную диаграмму (U,Q,A) (учитывать еще и (совершаемую газом) работу)
Оля: Идея! Общая (квазистатическая. А не статическая, как в термодинамике) диаграмма должна состоять из 4-х осей: T2, T1, p2, V1 (можно сказать, что это значение эквивалентно внешнему давлению (p1). Поскольку оно сравнивается с внутренним не моментально.),
где индекс 1 относится к источнику воздействия, а 2 – к приемнику (газовому телу).
Цикл Карно (идеальность и обратимость)
Ю.А.: Так в чем же все-таки секрет обратимости идеального цикла Карно? (См. «идеальная тепловая машина (машина Карно) обратима» [Мясникова С.П., Осанова Т.Н. Пособие по физике])
И как в обратном цикле (машины Карно) происходит охлаждение газа без испарения?
Петя: Может, потому, что он (цикл) состоит из специфических процессов – адиабат (или «изоэнтроп»)?
Оля: Но как же изотермы? Чем они специфичны?
Петя: А, понято! Ответ прост:
потому что этот цикл состоит из идеальных
(=обратимых) процессов. Которыми только и являются адиабатический и
изотермический.
Ю.А.: А как насчет того, что в холодильнике Карно происходит передача теплоты в сторону возрастания температуры?
Оля: Холодильник Карно отличается от тепловой машины Карно тем, что в нем работа тела над внешними силами (процессы по увеличению V) меньше работы внешних сил над телом (процессы по уменьшению V). В итоге общая работа тела отрицательная.
Ю.А.: Ну а что же теплота, сообщенная телу?
Оля: Теплота, сообщенная телу, меньше теплоты, отданной им. (Это видно на диаграмме S-T. Теплота телом получается, если его энтропия растет. В соответствии с формулой dQ=T*dS.)
Значит, общая сумма изменения внутренней энергии тела (в этом цикле) отрицательная – тело в итоге охлаждается.
Петя: Но это (происходит) вовсе не потому, что при этом теплота отдавалась телом с меньшей температурой. И вообще не понятно, где в этом процессе отдается теплота, ведь он состоит фактически из сжатий и расширений.
(И то, что в результате (так называемого) адиабатического сжатия температура повышается, это не означает (как это показано выше) вовсе, что «прибывает» теплота (как это трактуется на S-T диаграмме).)
Ю.А.: Непонятно также (в связи с этим) и то, зачем в рассуждениях о тепловой машине фигурируют холодильник и нагреватель.
Ведь действительно процесс нагрева и охлаждения (передачи теплоты) происходит только при контакте с телами другой температуры. А здесь только сжатия (и расширения).
Так что процесс, нарисованный Карно – это не более чем иллюзия. Вызванная тем, что быстрое сжатие не просто трактуется как нагрев, но как адиабатический нагрев.
Петя: А если быть более точным – как изоэнтропийный нагрев. Потому что адиабатическое сжатие действительно можно осуществить, если сжимать тело в условиях теплоизоляции. Но такое сжатие вовсе не будет изоэнтропийным.
Оля: Стоп-стоп! Но почему при сжатии мы обсуждаем опять энтропийный фактор? Ведь разве он не касается только нагрева?
Петя: При быстром сжатии плотность не поспевает за давлением, поэтому если процесс остановить и дождаться равновесия, то получим последействие – некоторое уменьшение давления.
Ю.А.: То есть энергия передана опять же не полностью, как и при энтропийном эффекте. В каком же случае она передается полностью?
Оля: До какой величины (понижается давление)? После быстрого сжатия?
Петя: Разумеется, до изотермической. Потому что только этот процесс (сжатия) (как и адиабатический (нет, опять ошибка! – изоэнтропийный!) процесс нагрева) – единственные равновесные процессы (в термодинамике). То есть в них происходят (-> фиксируются) действительные изменения состояния вещества (газа).
Смешанность процессов (передачи
энергии). Причины
Оля: Кстати, а почему при сжатии газа (параллельно) происходит его
разогрев? Ведь, казалось бы, при этом должна изменяться только концентрация
молекул. А оказывается, изменяется (увеличивается) еще и средняя скорость
молекул, что в итоге увеличивает и среднюю кинетическую энергию?
Как же так?
Может быть, увеличение концентрации увеличивает количество соударений
молекул?
Петя: За единицу времени? То есть нужно еще время на нагрев тела от
сжатия?
Оля: По крайней мере, вероятность соударений увеличивается точно.
Но почему соударения ведут к разогреву? То есть более вероятными становятся
попутные соударения? Но как такое получается? Ведь направления скоростей
равновероятны?
Петя: При уменьшении объема газового тела вероятность соударения (длина свободного пробега уменьшается) между молекулами увеличивается. В итоге газ становится более однородным по скоростям?
Иначе, как ни крути, получается, что параметр распределения скоростей молекул зависит от V (а не только от T).
Оля: А, понятно, почему при быстром сжатии происходит попутный нагрев! Потому что поверхностный слой оказывается пересыщенным быстрыми молекулами – ввиду большей доли быстрых молекул (в равновесном распределении)
Петя: И бОльшей плотности в поверхностном слое.
Так что можно сказать, что неизотермичность сжатия получается благодаря флуктуациям плотности – снаружи плотность уже увеличилась, а внутри – еще нет. Так как не успевает происходить перемешивание (сгущений).
Оля: Отсюда вывод: этот эффект (неперемешивание) тем больше, чем меньше температура.
Петя: И все это - вследствие быстроты сжатия.
Ю.А.: При быстром сжатии температура потому и увеличивается, что (даже средняя) плотность не успевает увеличиться в той же мере. Поэтому и равновесная температура (которая выйдет «на поверхность» при скором (то есть без перерыва (на установление равновесия)) обратном процессе) (в соответствии с законом состояния идеального газа) установится больше, чем при изотермическом сжатии.
Оля: В случае же быстрого нагрева мы имеем флуктуации скорости (молекул): на периферии больше, чем в глубине. Отсюда и … энтропийный фактор? Поскольку высокоскоростных молекул всегда больше возникает …(как бы) экран высокоскоростных для низкоскоростных.
Петя: При быстром нагреве (что получается при большом перепаде температур. И большой теплопроводности стенки) и энергии (кинетической) успевает передаваться меньше. Потому что сколько её передано - безусловно, зависит от времени передачи. Эта недодача энергии обнаруживается только потом (в виде заниженной температуры. А при охлаждении – в виде завышенной), когда наступит тепловое равновесие в (нагружаемом) газовом теле).
Ю.А.: Итак, после быстрого нагрева (хоть как-нибудь быстрого) дисперсия скорости сначала больше, чем равновесная (то есть скорость больше «размазана»).
Ну а при быстром сжатии? Чего дисперсия больше? Правильно: плотности молекул (которая обычно не рассматривается вообще).
Оля: А как же в итоге (при быстром сжатии) получается завышенной температура?
Ю.А.: Я удивлен твоему вопросу. Ведь чуть выше мы уже об этом сказали.
Петя: Да, а при адиабатическом нагреве – что, не повышается (сопутствующе) давление? А как же энтропийный эффект?
Ю.А.: Ты немного путаешь. Предлагаю тебе самому подумать, что именно.
Итак, (сопутствующий) нагрев при
сжатии – это искусственный эффект, что и
вызывает иллюзию того, что физический
смысл температуры – это плотность (кинетической) энергии молекул. На самом же
деле (если учесть искусственность (и временность) эффекта нагрева) – все
становится на свои места.
Достижение равновесия или еще раз о причинах энтропийного эффекта
Оля: Да, я поняла: повышение температуры при быстром сжатии происходит из-за того, что не успевает установиться равновесие между внешним телом (сжимающим) и исследуемым.
Ю.А.: Да, верно. И равновесие (достижение его) требует тем больше времени, чем больше температура (поскольку разброс скоростей при большей температуре увеличивается). Отсюда и энтропийный эффект (в размере) T*dS.
Петя: И тем больше времени, чем больше давление?
То есть существует еще какой-то аналогичный эффект для давления? Или он (как бы) отсутствует, в виду очень малой инертности вещества по отношению к плотности?
Я имею в виду по сравнению с инертностью по отношению к скорости (См. действительную инертность)
Оля: А, понятно, откуда инертность к плотности. В этом «виноват» коэффициент диффузии. Причем само(диффузии).
Петя: А инертность к скорости? Правильно, вязкость.
Ю.А.: Или коэффициент теплопроводности? Ведь скорость-то – молекул.
Петя: Да, точно, 2-ое. Поскольку предыдущее (вязкость) относится к переносу скорости в касательный слой.
Оля: Получается, что вязкость имеет место только при линейном (или хотя бы поступательном) движении? То есть она относится уже к более структурированным средам (чем идеальный газ)).
Петя: А как же (тогда) теплопроводность? Ведь она – за вычетом конвективной составляющей. Но конвекция имеет место только в гравитационном (или вообще силовом) поле! (которой в общем случае – нет)
Ю.А.: Вот и получается, что инертность к скорости – обусловлена все-таки теплопроводностью (=переносу скорости (молекул) поступательно и без движения газа).
Петя: Да. А вот инертность к плотности – это совместное действие диффузии и … вязкости.
17.11-14.12.04
Впервые опубликовано 11.01.05