[ Привет, физматика! ] [ Что нового на сайте ] [ Разобраться в теории ] [ Если не решается задача ] [ Тесты на понятливость ] [ Ну очень трудные задачи ] [ Короткие заметки ] [ Статьи ] [ Форумы ] [ О нас пишут ]
В «джунглях»
2-ого закона термодинамики или тайна энтропии
Существенное различие теплоты и работы
Юрий Афанасьевич (учитель физики) \в дальнейшем - просто Ю.А.\:
В этой встрече мы продолжим обсуждение, начатое в статье Энергетический подход,
потенциальность и термодинамика
И начнем свой разговор со 2-го начала термодинамики.
Петя: Закон №2 термодинамики давным-давно стал для меня камнем преткновения.
Ю.А.: Отчего же?
Петя: В 1-ую очередь меня смущает то, что он имеет несколько, как сказано в учебниках, эквивалентных форм выражения. А второй смущающий момент – сами эти формулировки.
Ну вот, например, одна из них: теплота и работа (как формы передачи энергии) не равноправны (=существенно различны): упорядоченное движение тела как целого (работа) может переходить в неупорядоченное без каких-либо компенсирующих процессов, а обратный переход (переход теплоты в работу) не может являться единственным результатом термодинамического процесса [Яворский Б.М., Детлаф А.А. Справочник по физике для инженеров и студентов вузов].
Как это понимать? Получается, что работа над телом теряется
в виде теплоты.
Ю.А.: В ядерной
физике известен феномен дефекта массы. Не видите ли вы здесь аналогии?
Дефект массы – это
на самом деле тот же (аналогичный) эффект, когда работа (над газовым телом)
«теряется» в виде теплоты. И здесь тоже энергия (а не масса) исходных атомов
теряется в виде энергии взаимодействия нуклонов в более тяжелом ядре.
Петя: Более
наглядным аналогом дефекта массы является нагревание шариков при столкновении.
Более наглядным потому, что в нем энергия не теряется. Точнее - теряется, но
известно куда. Кинетическая энергия «теряется» во внутреннюю.
Ю.А.: В виде дефекта
массы перед нами как раз и предстает закон асимметрии мира (и не только
пространственной, но и временнОй). Более сложное материальное образование
(=квазиравновесие) получается, но ценою потери части энергии исходных МО. Эта
энергия (потерянная) не исчезает – она как бы консервируется на более высоком
уровне движения материи.
Вывод: новую форму
движения (материи) – всегда видно как новую форму энергии. В данном случае
механическая форма движения материи переходит в тепловую в виде теплоты (мерой
которой является температура).
Оля: Но где сказано
о том, что работа теряется в виде теплоты? Точнее всё не так: энергия,
сообщенная телу во внутренней форме (то есть как теплота) частично используется
в виде работы (то есть движения тела (системы) как целого), а частично – запасается
в виде внутренней энергии.
Петя: Да, об этом
говорит 1-ый закон термодинамики: dQ=dU+dA.
Но в нем все
равновесно. Мы же говорим о неравновесии. Откуда же оно берется?.
Теплота и нагревание. Простые
процессы.
Петя: Другая
формулировка 2-го закона термодинамики выглядит так: «невозможен процесс, единственным результатом которого является совершение работы, эквивалентной
количеству теплоты, сообщенной телу в результате нагревания».
Но как еще можно
сообщать теплоту? Только нагреванием. Точнее – передача энергии посредством
нагревания – это передача теплоты (то есть выше сказано «масло
масляное»). А передача работы (а точнее – энергии в форме работы) – это всегда
сжатие (=изменение объема)…
Оля: Господи, как же
до сих пор эта вся путаница (с формулировками) в термодинамике продержалась?
(Зачем говорить длинно и запутанно: передача энергии в форме теплоты? Нельзя ли
сказать проще: нагрев тела?)
И ведь так уже
больше, чем 100 лет! Вот где еще были вставлены палки в колеса «телеги физики»!
Петя: … Так что в
итоге давление (как параметр) остается не у дел. Впрочем, не так: если газ
сжимают, то давление, естественно, растет. А вот чтобы давление при этом
зафиксировать, нужно одновременно еще и отнимать энергию в форме теплоты.
Оля: При сжатии газа
(в общем случае) увеличивается кроме давления, также еще и температура, при
нагревании – также еще и давление (кроме температуры). Поэтому, при нагревании
(чтобы его сделать чистым) давление можно стабилизировать,
одновременно расширяя
газ (=отнимая его энергию в форме работы). Вот и все премудрости.
Петя: И всё же сжатие – это (первоначально) уменьшение объема? Что-то мне не нравится этот параметр!
Уравнение состояния идеального газа дает следующую равносильную форму:
P*V=n*R*T => ro/mu*R= p/T => ro_mu=p/T_R (*),
где ro_mu = ro/mu = n/V – мольная плотность [моль/м^3], а
T_R = R*T - энергетическая температура (/мольная энергия) [Дж/моль]
Из уравнения состояния в таком виде (то есть все 3 параметра – именно функции состояния вещества, а не тела (см. V в старом уравнении. Да и m тоже)) следует, что в любом процессе изменяются как минимум две величины (назовем такие процессы простыми): давление и плотность – это сжатие (причем чистое. Но почему не любое (чистое) сжатие - одновременно и изотермическое? См. выше),
температура и давление – нагрев.
А если температура и плотность?
Это будет изобарический нагрев.
Так происходит с шариком в идеально гибкой оболочке (при наличии внешнего давления. Например, атмосферного). И тем не менее, это уже комбинированный процесс: нагрев + расширение.
Ю.А.: Именно про этот процесс (чуть выше) говорила Оля: нагрев, который с целью фиксации давления, совмещен с расширением.
Петя: Кстати, давление можно напрямую (то есть кратчайшим путем - в ходе простого процесса (кроме сжатия)) увеличивать! А именно - докачиванием (дополнительной порции) газа
(как это обычно и делается. Но незаметно. Потому что это докачивание быстро заканчивается. Как только давление уравняется.)
Так что добавление газа – это еще один способ воздействия на газовое тело.
Ю.А.: Да, но
добавление – это изменение массы газа. А масса – это все же параметр не
собственно газа (среды), а газового тела. От подобного же параметра (объема) мы
избавились выше (кстати, вместе с массой). Поскольку он был помехой для анализа
процессов, происходящих со средой.
Оля: Ну а как же изобары? Как они представлены среди простых процессов?
Петя: Изобарный нагрев – это и есть представитель изобар.
Оля: Но разве это всё? А изобарное сжатие?
А, понятно: изобарное сжатие – это тоже самое, что изобарный нагрев. Поскольку и там и там увеличивается температура и … плотность. Нет, при нагреве плотность уменьшается. Значит, эквивалентами являются изобарный нагрев и изобарное расширение, а также – изобарное сжатие и изобарное охлаждение. Это – 3-ья разновидность (чистых?) процессов, после сжатия и нагрева. Однако, совпадая формально (на диаграмме) они отличаются способом их проведения (см. соответственно сжатие и нагрев).
Петя: Я вот еще что подумал. Из закона состояния газа следует, что если нагревать тело, то при этом как минимум должны возрастать еще (сопутственно) либо давление (возрастает оно и при адиабатическом процессе), либо плотность (изобарический нагрев).
А также если сжимать тело, то вместе с давлением растет либо плотность, либо температура.
Но ведь тогда получается, что закон состояния неверно выражен! Ведь эти закономерности опять наводят на мысль, что температура – это отражение плотности энергии (как и давление). А не средней кинетической энергии молекул, как обычно она истолковывается.
Или все же
причина (естественного) повышения давления при нагреве какая-то иная?
Необратимость (процесса) как потеря энергии
Петя: Итак, в 1-ом
законе термодинамики нет неравновесности. Неравновесие (имманентное) пытаются
выразить во 2-ом законе.
Оля: Но в нем получается
какая-то несуразица: что природа движется не в сторону преумножения сложности
(=уменьшения энтропии. Если её понимать как степень беспорядка), а в
сторону уменьшения её. Стало быть, что-то не то со 2-ым законом! Как-то он
неправильно выражен!
Петя: 2-ой закон
термодинамики толкует о необратимых процессах. Но как можно понимать
необратимость процесса в пространстве функций состояния? Ведь функция состояния
– в том числе энергия. Которая по закону сохранения (1-ый закон термодинамики),
остается в сохранности.
Оля: А если нет? А
если по ходу процесса куда-то (странным образом) убегает?
Ю.А.: Именно так!
И необратимость (в
термодинамике) можно понимать только единственным образом: как
(безвозвратную) потерю энергии при передаче её газовому телу извне! Она кажется безвозвратной, поскольку уходит
во внутреннее движение газового тела (и уходит действительно безвозвратно, если
мы не научились её оттуда извлекать). Именно так и следует понимать 2-ое начало
термодинамики: что сообщаемая телу энергия (не важно в каком виде, теплоты или
работы. Или все-таки только в виде теплоты?) переходит во внутреннюю энергию с
потерями.
Отсюда и
необратимость (то есть, потеряв энергию, мы уже не можем возвратить тело в
прежнее состояние)
Петя: Да, это аналогично
маятнику часов, который не может вовратиться в прежнее (крайнее) положение,
если в точке подвеса есть трение.
Ю.А.: Из чего
следует такой вывод? Из того, что энтропия сначала определяется как dS=dQ/T (1), а потом утверждается, что в
(необратимом) процессе dS> dQ/T
(2)(и это есть еще одна формулировка 2-го закона термодинамики (неравенство
Клаузиуса)! [Яворский, Детлаф. Справочник по физике для инженеров и
студентов вузов]). Отсюда легко сделать вывод: под энтропией во высказывании
(2) имеется в виду вовсе не то, что в (1). То есть температура тела поднимается на меньшую величину, чем
если бы вся сообщенная извне (в виде теплоты) энергия (которую и символизирует TdS – как выражение от функций состояния)
перешла во внутреннюю энергию. То есть фактически сообщается
энергия – dQ (что есть уже не функция состояния. Поэтому
для неё допустимо быть не сохраненной. Что не допустимо для энергии.). Именно с
таким пониманием и согласуется 1-ая формулировка 2-го начала: «невозможен
процесс, единственным результатом которого
является совершение работы, эквивалентной количеству теплоты, сообщенной
телу в результате нагревания»
Петя: Стало быть,
правильная запись 2-го начала термодинамики: dQ=dU+TdS.
А точнее – dQ=dU+(TdS-dQ), то есть частично энергия, сообщаемая путем
нагревания, переходит в некую энтропию.
Хотя опять не очень
точно. И все из-за того, что определение энтропии неясно. Можно только
предполагать, как оно получено.
Оля: Энтропия
впервые предстает перед нами как dS=dQ/T. Но откуда появляется физический смысл у этого
комплекса?
Мера внутренней
энергии тела – это его температура. Согласно определению (энтропии),
если при большей температуре (большей внутренней энергии) передавать телу
равное количество теплоты, то передаваемая энтропия будет меньшей, чем при
передаче того же количества теплоты на меньшей температуре.
Стоп-стоп-стоп! Но разве передаваемая теплота не пропорциональна температуре? Нет, изменению температуры. Вот и получается, что при передаче на большей температуре относительное изменение температуры (dT/T) будет меньше, чем при передаче на меньшей. То есть: относительное изменение температуры – это и есть мера (сообщаемой) энтропии! Иначе: для передачи телу равной энтропии на большей температуре необходимо передать (пропорционально) большее количество теплоты. В этом содержится следующая мысль: шкала температур нелинейна по отношению к шкале энтропий. Иначе: чем выше по шкале энтропий, тем больше цена деления на шкале температур.
Ю.А.: Более
подробно о том, из каких соображений
получено определение энтропии как dS=dQ/T
и к чему оно приводит можно узнать из Паралогизмы в
физике
.
Оля: А как получено (значение) dS? А точнее – какое количество теплоты (dQ) заложено в него?
Петя: Определяемое при нагревании газа – по увеличению его
температуры. А вот dQ,
которое стоит справа в формуле 2-го начала (неравенстве
Клаузиуса) – это теплота, полученная по
расширению газа (после нагревания).
Оля: Но как
обеспечить соответствие (в опыте) этих величин?
Если газ сначала
нагревать а потом расширять, то как выяснить, до какого момента его расширять?
Может быть, его сначала сжимать (и он тогда еще и нагреется), а потом расширять
(до того же= первоначального) объема?
Петя: Нет, лучше
так: газ нужно одновременно нагревать и расширять (сохраняя постоянным
давление). В итоге выяснится, что в этом процессе CdT> pdV (то есть сообщенная теплота больше
(затраченной) работы – над внешней средой). Это и есть 2-ое начало
термодинамики.
Оля: А если параллельно
газ сжимать и охлаждать? (поддерживая постоянной температуру) Не получим ли мы
тот же результат?
Петя: Да, получим.
Но только уже в обратную сторону: pdV>
CdT. Вот тогда и
посмотрим, какая из форм (работа или теплота) более необратима?
По разности этих
величин. Точнее, по знаку этой разности.
2-ой закон
термодинамики (передача от холодного к горячему). Холодильник.
Оля: Раз всё так просто (с истолкованием 2-го закона термодинамики), то с чем же связана коллизия в его понимании?
Ю.А.: Основная коллизия, относящаяся (в школе) к 2-ому началу термодинамики, думаю, связана с нестыковкой 2-х, как говорят, равносильных его формулировок. А вовсе не с определением энтропии (и равносильной формулировки (2-го начала), через энтропию – неравенством Клаузиуса)
А именно: как
(теперь, то есть после истолкования 1-ой формулировки и неравенства Клаузиуса)
истолковать следующую формулировку 2-го закона: «невозможен
процесс, единственным результатом которого является передача теплоты от
холодного тела к горячему (без каких-либо других изменений)».
Оля: Стоп, но
здесь-то вообще абсурд! Ведь такой процесс вообще невозможен!
Петя: И причем не
важно, с какими-то «другими изменениями» или без них. Передача теплоты
происходит только по градиенту температуры (то есть в сторону её уменьшения) –
это известно из теории теплопередачи. Хотелось бы только знать, откуда
произошла эта нелепица?
Оля: На самом же
деле здесь имеется в виду, наверно, принцип работы холодильника: если какое-то
тело охлаждается (продукты в морозильной камере), то только посредством
нагревания какого-то другого тела (хладоагента). Правда, здесь не учитывается,
что на самом деле съем теплоты в холодильнике осуществляется за счет испарения
хладоагента (так что при этом его температура может и не увеличиваться!)…
Петя: Еще раз не
могу не удивиться, как всё-таки эта нелепость с передачей теплоты от холодного
тела к горячему (якобы возможная при каких-то других изменениях) попала в
учебники.
Оля: … После этого
его (хладоагент) отводят от охлаждаемого тела и сжижают. Что делается за счет
его сжатия (при температуре ниже критической).
Петя: Следовательно,
сначала его надо охладить.
Оля: Да, это и
происходит в конденсаторе (на задней стенке холодильника). Именно здесь
теплота, отнятая от охлаждаемого тела, отдается воздуху помещения. Но без
каких-либо нарушений закона градиента температуры.
Ю.А.: Вам известно, должно быть,
что в термодинамике рассматривается (как идеальная) так называемая машина
Карно. Может быть, именно в этой машине (поскольку она идеальна) и
происходит это чудо – передача теплоты от холодного тела к горячему?
Оля: Вот теперь (после вразумительного истолкования 2-го начала термодинамики), пожалуй, можно и разобраться с «идеальностью» машины (цикла) Карно. В чем же его идеальность? В том, что он обратим? Но ведь и здесь теплота передается также с (энтропийным) «налогом».
Петя: А, вот, интересно: а если теплота не передается, а отнимается (то есть машина (Карно) работает в режиме холодильника)? То (энтропийный) «налог» будет тоже с обратным знаком (то есть положительный)? Или с тем же? То есть также будут иметь место потери при передаче теплоты?
Оля: То есть отниматься будет больше, чем (изначально) отнимается? Как же это понимать?
Петя: А вот как: температура газа будет понижаться больше, чем повышаться у (отнимающей у него теплоту) жидкости (с той же теплоемкостью.
См.также потенциальная часть во внутренней энергии. (Поскольку эта часть уже не «отвечает» за температуру.) У жидкостей она явно больше.)!
Оля: А если будут два (контактирующих) газа?
Петя: Вот тогда-то и будет наблюдаться эффект идеальности машины! Поскольку энтропийные эффекты будут одинаковые.
Причины потерь
энергии
(энтропийного эффекта) с позиций МКТВ
Оля: Из-за чего это
(потери энергии) при передаче теплоты происходит?
Петя: Понятно, из-за
чего – из-за внутреннего трения газа. Ведь все
потери – от трения.
Оля: А
при чем же здесь тогда энтропия (см. неравенство Клаузиуса)? И как объяснить,
что потери теплоты пропорциональны температуре?
Петя: Частично
энергия, сообщаемая путем нагревания, переходит в некую энтропию.
А на самом деле - во
внутреннюю форму энергии … по отношению … уже к теплоте. То есть
это часть энергии, запасаемая уже не в форме движения молекул (которая и
отображается как температура), а в форме движения внутри молекул. То есть
движения атомов – в молекуле. Кстати, а вращательное движение молекул тоже
отображается в виде температуры?
Оля: А нет ли там, в
газе, образования каких-то ансамблей молекул?
Петя: Нет, газ
потому и газ, что в нем нет ближней
упорядоченности. В твердости наоборот – идеальная ближняя упорядоченность. В
жидкости имеется упорядоченность среднего порядка. То есть она (жидкость)
несжимаемая, но зато текучая.
Ю.А.: Согласно молекулярно-кинетической вещества (МКТВ) температуре
соответствует средняя кинетическая энергия молекул (то есть в конечном счете мат.ожидание
скорости).
Но чему же тогда соответствует дисперсия скорости (2-ая
характеристика распределения скоростей)? Может, это и есть та самая мифическая
энтропия – причина необратимости процессов в термодинамике?
Петя: Да, таким образом и получается некий аналог трения при передаче
энергии (-> при преобразовании работы в теплоту, а затем обратно).
Оля: Понятно! Так как скорости молекул (газа) распределены показательно (рис.1), то есть по закону
f(x)=2*x/l^2*exp(-(x/l)^2)
(где l - это мода скорости) (см. Масквелловское распределение скоростей),
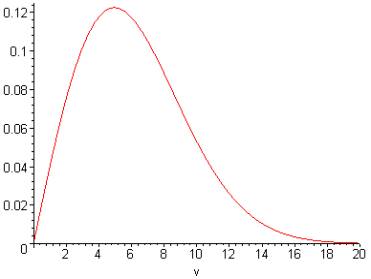
Рис.1.Распределение скоростей молекул газа
то отсюда получаем мат.ожидание и дисперсию скорости молекулы:
M(x)=1/2*sqrt(l^2*pi), D(x)=1/2*sqrt(4*l^2+Pi*(l^2-2*l^3))
Это показывает, что действительно M(x) (в 1-ом приближении) пропорционально l, и то же самое – D(x).
Что подтверждает гипотезу о том, что энтропия тем больше, чем больше температура.
Петя: И что энтропия (как и температура) – это характеристика газа (как и считается в термодинамике).
Но чем же объяснить энтропийный
эффект (то есть саму потерю энергии)? Может, тем, что при охлаждении газа
(судя по его распределению – см. рис.2) из него 1-ым делом уходят более
энергетичные молекулы?
Оля: А при нагревании – наоборот? См. энтропийный эффект в холодильнике.
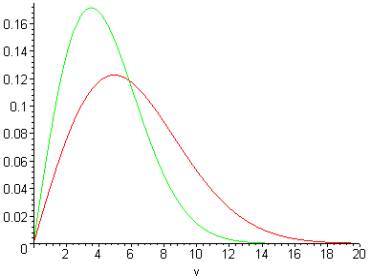
Рис.2.Взимодействие 2-х распределений скоростей
Петя: Но почему?
Оля: Что почему?
Петя: Почему (при этом) при нагревании газа – 1-ым делом в него входят (передают свою энергию) наименее энергетичные молекулы. Ведь здесь одно противоречит другому (см. выше, при охлаждении).
Оля: Не совсем так. Потому что у (находящихся в тепловом взаимодействии) газов – разные температуры …
Петя: А, вот, понял: «виновата» здесь асимметрия распределения в сторону увеличения и в сторону уменьшения (скорости). Со 2-ой стороны отклонение (разброс) меньше, чем с 1-ой.
(Да, вот что: нужно использовать момент 3-его (нечетного) порядка. Асимметрия – эта характеристика (распределения) так и называется.)
Вот это и будет выход на энтропи … йный фактор.
Оля: Кроме того у газа с большей температурой больше и разброс энергий по молекулам, с меньшей – меньше.
(То есть при нагревании тела энергия его «размазывается» по бОльшему диапозону
скоростей (энергий) молекул.
Но при любой температуре доля ВСк молекул всегда больше, чем доля НСк.)
Стало быть, при охлаждении тела (газа) доля высокоскоростных
(относительно средней) (ВСк) молекул уменьшается, а низкоскоростных (НСк) –
увеличивается. Но увеличение НСк больше, чем уменьшение ВСк => суммарная
энергия уменьшится, и причем с опережением по отношению к уменьшению
температуры.
Холодное же тело (в этом же процессе) долю ВСк молекул увеличивает, а
НСК – уменьшает. Но разница между уменьшением НСк и увеличением ВСк у холодного
тела меньше, чем у горячего.
Петя: Думаю, что основное, чтобы понять энтропийный фактор - это понять, как энергия передается в форме теплоты.
Оля: И почему при сжатии (газа) повышается также температура.
Петя: Во-2ых, возможно поможет з-н обмена скоростей тел относительно ЦМ (при упругом соударении): тела после соударения меняют знак своих скоростей относительно цм всей системы
В частном случае, при m1=m2, получается:
V1c’=v1- (v1+v2)/2= -(v2-v1)/2
V2c’=v2- (v1+v2)/2= -(v1-v2)/2
V1’=(v1+v2)/2+ (v2-v1)/2= v2
V2’=(v1+v2)/2+ (v1-v2)/2= v1
А также нужно помнить свойства закона распределения скоростей – сдвиг мат.ожидания скорости и изменения общей плотности (частотности) в объеме (в зависимости от температуры).
Оля: То есть поскольку температура газа повышается также и от сжатия, то и при сжатии газа его з-н распределения сдвигается в сторону более ВСк-ных молекул?
Абсолютный нуль
температуры. 3-ий закон термодинамики.
Адиабатический и изотермический процессы как особые процессы.
Петя: А ведь
получается, что постулирование (абсолютного) нуля температур (а точнее –
запрещение отрицательных (в абсолюте) температур!) губит физику (->
термодинамику)!
Ю.А.: Почему это?
Далее
17.11-14.12.04
Впервые опубликовано 7.01.05