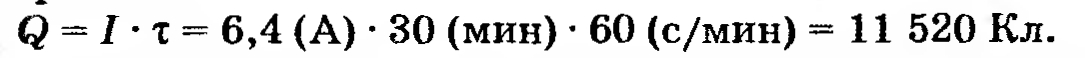 Решебник по химии за 10 класс (Л. С. Гузей, Р. П. Суровцева, 1999 год) , №24 к главе «Задачи к § 28.3». Решебник по химии за 10 класс (Л. С. Гузей, Р. П. Суровцева, 1999 год) , №24 к главе «Задачи к § 28.3».
|
Условие задачи: 24*. МГУ97. При пропускании постоянного тока силой 6,4 А в течение 30 мин через расплав хлорида неизвестного металла на катоде выделилось 1,07 г металла. Определите состав соли, которую подвергли электролизу.
Сначала вычислим количество прошедшего через расплав электричества:
Обозначим валентность металла в расплаве п и его молярную массу А. Тогда процесс на катоде можно изобразить так:
Далее составим таблицу:
|
п |
1 |
2 |
3 |
4 |
|
А |
9 |
18 |
27 |
32 |
Сопоставим найденные атомные массы с массами химических элементов, приведенных в периодической системе. Видим, что всем условиям отвечает Аl.
Формула хлорида АlСl3.