Решебник по химии за 10 класс (Г. Е.Рудзитис, Ф. Г.Фельдман, 2000 год), №15 к главе «Глава I. Теория химического строения органических соединений. Электронная природа химических связей §§1-4 (стр. 11). Вопросы». Решебник по химии за 10 класс (Г. Е.Рудзитис, Ф. Г.Фельдман, 2000 год), №15 к главе «Глава I. Теория химического строения органических соединений. Электронная природа химических связей §§1-4 (стр. 11). Вопросы».
|
Условие задачи: №15. Какова сущность процесса образования ковалентных связей с учетом характера движения электронов в атомах? Свой ответ поясните конкретными примерами.
Ковалентные связи образуются за счет общих пар электронов. В образовании ковалентной связи могут участвовать и s-электроны, и р-электроны, но только находящиеся на внешней электронной оболочке. Примеры:
1) Молекула водорода H2.
Атом водорода имеет один электрон на 1 s-орбитали. Каждый атом водорода предоставляет по одному электрону для образования ковалентной связи.
2) Молекула аммиака NH3.
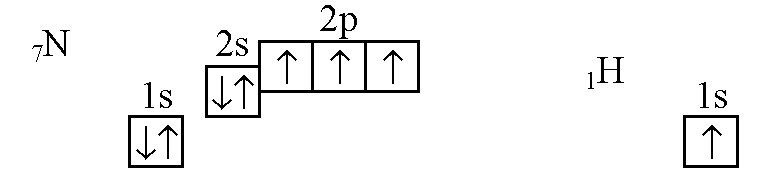
Атом водорода имеет один электрон на 1s-орбитали. Строение электронной оболочки атома азота 1s22s22р3. Изобразим расположение электронов в атомах водорода и азота по орбиталям:
У атома водорода один неспаренный электрон на 1s-орбитали, у атома азота три неспаренных электрона на 2р-орбитали. Значит, атом водорода может образовать одну ковалентную связь, а атом азота — три ковалентные связи. Следовательно, атом азота может соединяться с тремя атомами водорода, образуя молекулу аммиака NH3.