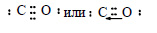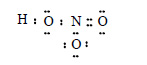Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №12 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №12 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома».
|
Условие задачи: Составьте электронные схемы, отражающие валентность азота в азотной кислоте и валентность углерода и кислорода в оксиде углерода (II).
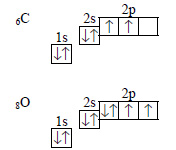
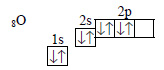
а) Молекула оксида углерода. Строение электронных оболочек атомов углерода и кислорода:
В молекуле оксида углерода две связи образованы за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода. У атома кислорода есть еще пара электронов на 2р-орбитали, а у атома углерода – свободная 2р-орбиталь. Пара электронов переходит от атома кислорода к атому углерода, образуют донорно-акцепторную связь. Электронную формулу оксида углерода (II) можно изобразить так:
(стрелочкой обозначена донорно-акцепторная связь).
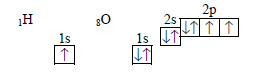
б) Молекула азотной кислоты. Электронные схемы атомов водорода, кислорода и азота:
Атом водорода образует за счет единственного электрона связь с атомом кислорода. Второй электрон атома кислорода участвует в образовании связи с атомом азота:
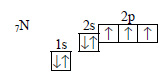
У атома азота остается два неспаренных электрона, и он образует две связи со вторым атомом кислорода:
У атома азота осталась еще электронная пара на 2s-орбитали. В третьем атоме кислорода происходит спаривание электронов, и образуется свободная орбиталь:
Пара электронов от атома азота переходит на освободившуюся орбиталь атома кислорода и образуется донорно-акцепторная связь: