Фундаментом молекулярно-кинетической теории является гипотеза, что все тела в природе состоят из мельчайших структурных единиц — атомов и молекул (комбинаций атомов). Атомистическая гипотеза зародилась 2 500 лет назад в Древней Греции (Левкипп и Демокрит из Абдеры) и была окончательно сформулирована в трудах европейских ученых XIX в. За сто лет до этого выдающийся русский ученый-энциклопедист М. В. Ломоносов рассматривал тепловые явления как результат движения частиц, образующих тела.
Основные положения. Вещество состоит из атомов (молекул) . Размеры атомов (молекул) равны 10 -10 — 10 -9 м. Число атомов (молекул) в единице объема вещества (твердого тела или жидкости) порядка 1022 частиц в 1 см3.
Атомы (молекулы) вещества находятся в непрерывном хаотическом тепловом движении. Наиболее яркое доказательство — броуновское движение (Р. Броун, 1827 г.) мелких частиц, взвешенных в жидкости, происходящее из-за непрерывных беспорядочных соударений этих частиц с молекулами жидкости. Другой простой экспериментальный факт, доказывающий тепловое движение атомов вещества, это диффузия.
Между атомами (молекулами) вещества действуют силы притяжения и отталкивания, зависящие от расстояния между частицами. На далеких расстояниях (превышающих несколько радиусов молекулы) взаимодействие слабо и носит характер притяжения, быстро убывающего с ростом расстояния (сила притяжения меняется как r -7 ). Физически это слабое притяжение обусловлено наличием электрического дипольного момента у электронейтральной в целом молекулы. С уменьшением расстояния это притяжение сначала несколько возрастает, а затем стремится к нулю. В момент соприкосновения электронных оболочек молекул возникают быстро растущие с уменьшением расстояния силы электростатического отталкивания.
Характер теплового движения молекул зависит от того, в каком агрегатном состоянии (твердом, жидком или газообразном) находится вещество. Расстояние между отдельными молекулами (атомами) в газах очень велико по сравнению с размерами самих молекул. Поэтому силы притяжения между молекулами в газе пренебрежимо малы. Следовательно, газы могут неограниченно расширяться, занимая любой предоставленный им объем. Молекулы в жидкости расположены достаточно близко друг к другу, так что при попытке сжатия жидкости возникают большие силы отталкивания. Отсюда малая сжимаемость жидкостей. С другой стороны, всякая внешняя сила заставляет молекулы жидкости перемещаться, что объясняет текучесть жидкости. В твердом теле атомы или молекулы могут лишь колебаться вокруг определенных положений равновесия. Поэтому твердые тела сохраняют и форму, и объем. У кристаллических твердых тел центры атомов (молекул) образуют пространственную решетку, в узлах которой находятся атомы вещества. Аморфные твердые тела не обладают жесткой структурой и скорее напоминают застывшие жидкости (в частности, под действием определенной силы аморфное тело может течь как жидкость).
Характеристики числа и массы атомов (молекул). Массы атомов (молекул) весьма малы в привычных единицах (порядка 10 -26 кг), поэтому для их описания используют относительные единицы. По определению массу молекулы (атома) любого вещества m 0 относят к 1/12 массы атома углерода m 0C и называют относительной атомной массой M отн :
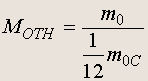 (1.1)
(1.1)
Далее вводят понятие количества вещества. Если измерять его числом атомов (молекул), то получающиеся цифры настолько велики, что ими неудобно оперировать. Поэтому вводят единицу количества вещества — моль . По определению один моль равен количеству вещества, в котором содержится столько же атомов, сколько их содержится в 0,012 кг чистого углерода. Таким образом, число атомов в одном моле всех веществ одинаково. Оно называется числом Авогадро:
![]()
Количество вещества равно отношению числа атомов (молекул) этого вещества к числу Авогадро:
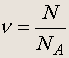 (1.2)
(1.2)
Размерность: [ n ] = моль .
Молярная масса M равна массе вещества, взятого в количестве одного моля.
[M] = кг/моль . Из предыдущих определений следует, что молярная масса углерода равна ровно 0,012 кг. Молярная масса равна
![]() (1.3)
(1.3)
где m 0 — масса отдельного атома (молекулы). Масса m любого количества вещества, содержащего N атомов (молекул), равна
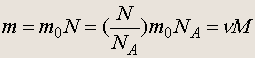 (1.4)
(1.4)
откуда количество вещества (в молях) равно
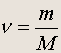 (1.5)
(1.5)
