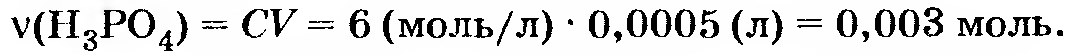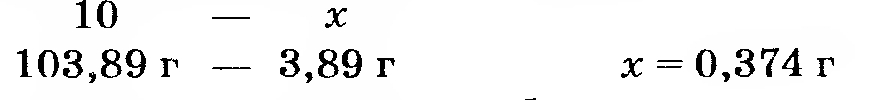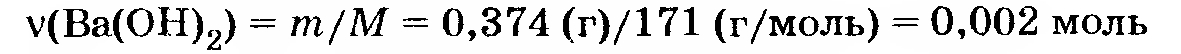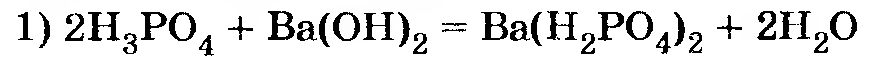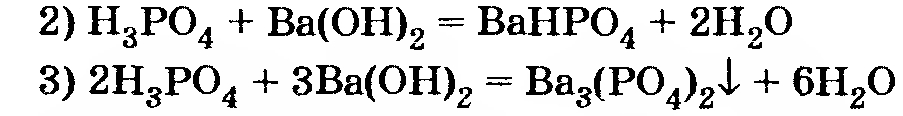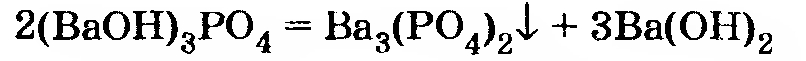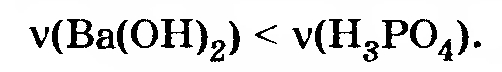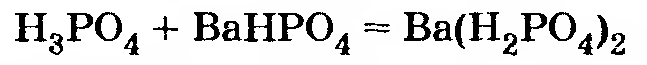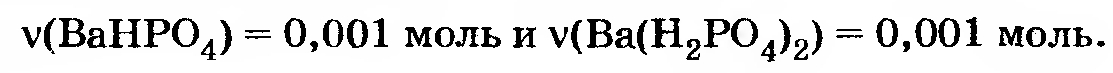 Решебник по химии за 10 класс (Л. С. Гузей, Р. П. Суровцева, 1999 год) , №13 к главе «Задачи к § 25.5». Решебник по химии за 10 класс (Л. С. Гузей, Р. П. Суровцева, 1999 год) , №13 к главе «Задачи к § 25.5».
|
Условие задачи: 13*. ММА. К 0,5 мл раствора фосфорной кислоты с концентрацией 6 моль/л добавили 10 г насыщенного раствора гидроксида бария (растворимость 3,89 г в 100 г воды). Вычислите количестве веществ образовавшихся соединений бария.
Вычисляем количества веществ-реагентов:
Массу гидроксида бария найдем из пропорции
Отсюда количество гидроксида бария
Возможные реакции:
(Мы не рассматриваем возможность образования основного фосфата бария, так как он не существует из-за неминуемой реакции
с выпадением осадка.)
Исходные количества реагентов не соответствуют ни одному из написанных уравнений. При этом уравнение 3 можно вообще не рассматривать, так как соответствующая реакция требует, чтобы выполнялось условие
а здесь наоборот
Вывод: образуется смесь веществ Ва(Н2РO4)2 и ВаНРO4. Чтобы вычислить их количества, можно исходить из любой из двух первых реакций. За исходное уравнение удобнее принять уравнение 2.
В этой реакции на имеющееся количество гидроксида бария (0,002 моль) расходуется столько же фосфорной кислоты и образуется 0,002 моль гидрофосфата. Остается в избытке кислота
0,003 — 0,002 = 0,001 моль Н3РO4, и она вступает в реакцию
В этой реакции на 0,001 моль Н3РO4 расходуется столько же ВаНРO4 и образуется столько же Ва(Н2РO4)2.
Таким образом, в полученном растворе количества веществ (соединений бария) равны: