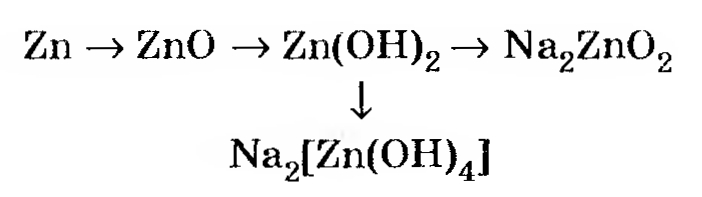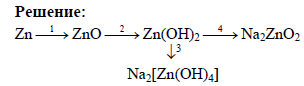 Решебник по химии за 10 класс (Л. С. Гузей, Р. П. Суровцева, 1999 год) , № к главе «Задачи к § 29.3». Решебник по химии за 10 класс (Л. С. Гузей, Р. П. Суровцева, 1999 год) , № к главе «Задачи к § 29.3».
|
Условие задачи: Задачи 1-5,9 к § 29.3
1. Где используется способность цинка вытеснять водород из кислот? Напишите уравнение соответствующей реакции.
Решение:
Способность цинка вытеснять водород из кислот используется
для получения водорода:
Zn + 2H + = Zn 2+ + H2^.
2Т. Водород не выделяется в реакции цинка с водным раствором А) NaOH Б) НСl В) HNO3 Г) H2SO4,разб
Ответ:
В) HNO3.
В реакциях с азотной кислотой водород никогда не выделяется.
3. Напишите полные и сокращенные ионные уравнения реакций, демонстрирующих кислотные и основные свойства оксида цинка.
Решение:
Уравнения реакций:
1. ZnO + 2HCl = ZnCl2 + H2O.
Сокращенная форма:
ZnO + 2H + = Zn 2+ + H2O.
2. H2O + ZnO + 2KOH = K2[Zn(OH)4].
Сокращенная форма:
H2O + ZnO + 2OH? = [Zn(OH)4] 2 ?.
4. Напишите полные и сокращенные ионные уравнения реакций, демонстрирующих кислотные и основные свойства гидроксида цинка.
Ответ:
Уравнения реакций:
1) Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
Сокращенная форма:
2OH? + 2H + = 2H2O
2) Zn(OH)2 + 2KOH = K2[Zn(OH)4]
Сокращенная форма:
Zn 2+ + 4OH? = [Zn(OH)4]2?.
5. Охарактеризуйте явления (напишите соответствующие ионные уравнения реакций), которые последовательно будут наблюдаться при постепенном приливании избытка раствора щелочи к раствору соли цинка, а затем избытка соляной кислоты к полученному раствору.
Решение:
Уравнения реакций:
1) ZnCl2 + 2NaOH = Zn(OH)2v + 2NaCl.
2) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
3) Na2[Zn(OH)4] + 2HCl = Zn(OH)2v + 2NaCl + 2H2O
4) Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
9. МПГУ96. Напишите уравнения реакций следующих превращений:
1) 2Zn + O2 = 2ZnO
2) ZnO + 2HCl = ZnCl2 + H2O
ZnCl2 + NaOH = Zn(OH)2v + 2NaCl
3) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
4) Zn(OH)2 + 2NaOH =спл= Na2ZnO2 + 2H2O^