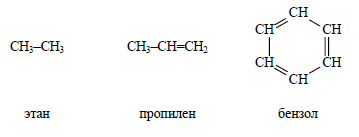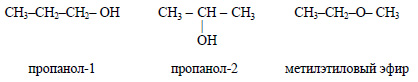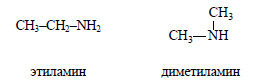Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №1 к главе «Глава XIV. Обобщение знаний по курсу органической химии». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №1 к главе «Глава XIV. Обобщение знаний по курсу органической химии».
|
Условие задачи: Кроме примеров, указанных в параграфе, приведите еще два-три примера, подтверждающих каждое из предположений теории А. М. Бутлерова.
1) Все атомы, входящие в молекулы органических веществ, соединены в определенной последовательности.
Очевидно, что для любого вещества можно изобразить структурную формулу. Нарисуем структурные формулы этана, пропилена и бензола:
2) Свойства веществ зависят не только от состава (то есть от того, какие атомы входят в состав молекулы), но и от строения (то есть от того, как именно они соединены).
Несколько веществ с одинаковой молекулярной формулой могут иметь различное строение. Например, формуле C3H8O соответствует три изомера – пропанол-1, пропанол-2 и метилэтиловый эфир:
Формуле C2H7N соответствуют этиламин и диметиламин:
3) По свойствам вещества можно объяснить его строение, а по строению – предвидеть свойства.
Например, карбоновые кислоты содержат карбоксильную группу, и можно предвидеть, что атом водорода карбоксильной группы будет замещаться на атом металла при реакции с основаниями. С другой стороны, если известен факт, что карбоновые кислоты реагируют с основаниями, это можно объяснить присутствием в молекуле карбоксильной группы.
В молекулах алкенов есть двойная связь. Присоединение к алкенам брома объясняется именно наличием в молекуле двойной связи. С другой стороны, если в молекуле есть двойная связь, то можно предвидеть, что вещество будет реагировать с бромом.
4) Атомы и группы атомов в молекулах влияют друг на друга.
В молекуле фенола происходит смещение электронов от атома кислорода к бензольному кольцу, и вследствие этого электроны атома водорода в большей степени смещаются к атому кислорода. Связь между атомами водорода и кислорода становится более полярной и поэтому разрывается легче, чем в спиртах. Атом водорода в фенолах легче замещается на металл, чем в спиртах, то есть является более подвижным.
Хлоруксусная кислота сильнее, чем уксусная кислота. Электроотрицательность атома хлора выше, чем атома углерода. Поэтому хлор оттягивает на себя электроны, участвующие в образовании химической связи между атомами хлора и кислорода. Этот эффект смещения электронной плотности передается по цепочке химических связей к ОН-группе. В результате связь О–Н в карбоксильной группе становится более полярной и поэтому легче разрывается. В результате хлоруксусная кислота диссоциирует на ионы легче, чем уксусная кислота, то есть является более сильной кислотой.