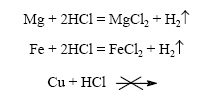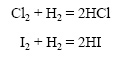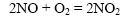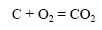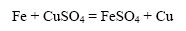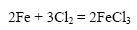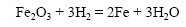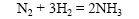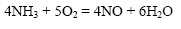Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №6 к главе «Глава IV. Химические реакции». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №6 к главе «Глава IV. Химические реакции».
|
Условие задачи: На конкретных примерах укажите основные факторы, влияющие на скорость химических реакций.
1) Скорость реакции зависит от природы реагирующих веществ.
Металлы реагируют с соляной кислотой с различной скоро — стью: магний реагирует быстрее железа, а медь не реагирует вовсе (за скоростью реакции легко следить по выделению пузырьков водорода).
Галогены реагируют с водородом с различной скоростью, например хлор быстрее йода:
2) Для веществ в растворенном состоянии и газов скорость реакции зависит от концентрации реагирующих веществ.
Оксид азота (II) реагирует с чистым кислородом быстрее, чем с воздухом, в котором кислорода около 20% (за изменением скорости реакции легко наблюдать, так как исходные вещества бесцветны, а оксид азота (IV) окрашен в коричневый цвет).
3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
Чем сильнее измельчено твердое вещество, тем больше его поверхность. Уголь в виде больших кусков сгорает в печи медленнее, чем измельченный:
Железные опилки реагируют с раствором сульфата меди быстрее, чем железная пластинка такой же массы:
4) При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2–4 раза.
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет.
5) Скорость реакции зависит от присутствия некоторых веществ (катализаторов и ингибиторов).
Реакция синтеза аммиака из азота и водорода протекает только в присутствии катализаторов (железа со специальными добавками):
Реакция окисления аммиака также протекает только в присутствии катализатора (платины):