Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №10 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №10 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома».
|
Условие задачи: Почему численное значение валентности не всегда совпадает с числом электронов на наружных энергетических уровнях?
Образование химических связей возможно при наличии в атоме неспаренных электронов. Во многих элементах не все электроны внешнего электронного уровня являются неспаренными.
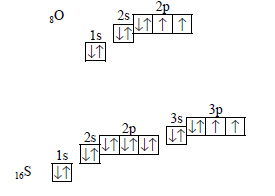
Например, в атомах кислорода и серы по шесть электронов на внешнем уровне, но из них только два неспаренных:
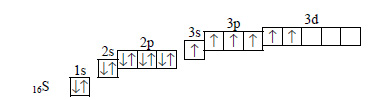
Однако, в атоме серы на внешнем электронном уровне есть еще пустые 3d-орбитали, на которые могут переходить электроны с 3s — и 3р-орбиталей, в результате в атоме серы становится шесть неспаренных электронов:
Поэтому максимальная валентность серы равна шести, то есть совпадает с числом электронов на внешнем электронном уровне. В атоме кислорода на втором уровне нет d-орбиталей, поэтому нет возможности для распаривания электронов, и валентность кислорода не может быть больше двух, то есть не равна числу электронов на внешнем уровне.