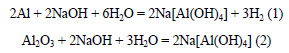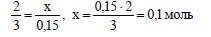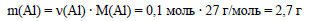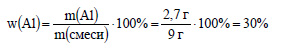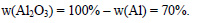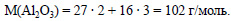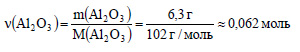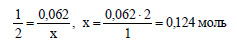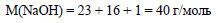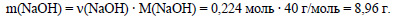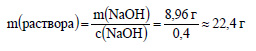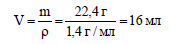Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №4 к главе «Глава V. Металлы». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №4 к главе «Глава V. Металлы».
|
Условие задачи: При действии на 9 г смеси, состоящей из металлического алюминия и его оксида, 40%-ным раствором гидроксида натрия (? = 1,4 г/см3) выделилось 3,36 л газа (н. у.). Определите процентный состав исходной смеси и объем раствора NaOH, вступившего в реакцию.
Решение:
Уравнения реакций:
Вычислим количество вещества выделившегося водорода:
По уравнению реакции при взаимодействии 2 моль алюминия с раствором щелочи выделяется 3 моль водорода. Пусть 0,15 моль водорода выделится при реакции x моль алюминия с раствором щелочи. Составим пропорцию:
Молярная масса алюминия равна 27 г/моль, вычислим массу алюминия:
Вычислим массовую долю алюминия в смеси:
Вычислим массовую долю оксида алюминия в смеси:
По уравнению (1) 2 моль алюминия реагирует с 2 моль гидроксида натрия, значит 0,1 моль алюминия реагирует с 0,1 моль гидроксида натрия. В смеси содержится 9 – 2,7 = 6,3 г оксида алюминия. Вычислим молярную массу оксида алюминия:
Вычислим количество вещества оксида алюминия:
По уравнению реакции (2) 1 моль оксида алюминия реагирует с 2 моль гидроксида алюминия. Пусть 0,062 моль оксида алюминия реагирует с х моль гидроксида натрия. Составим пропорцию:
Таким образом, всего необходимо 0,1 + 0,124 = 0,224 моль гидроксида натрия. Определим молярную массу гидроксида натрия:
Вычислим массу гидроксида натрия:
Вычислим массу раствора гидроксида натрия с концентрацией 40%, или 0,4.
Вычислим объем раствора: гидроксида натрия:
Ответ: в смеси содержится 30% алюминия и 70% оксида алюминия; потребуется 16 мл раствора гидроксида натрия.