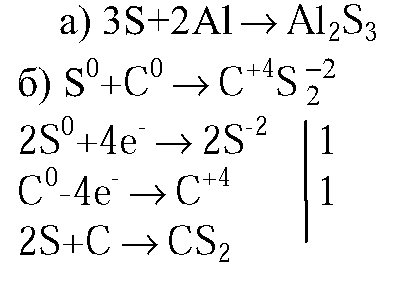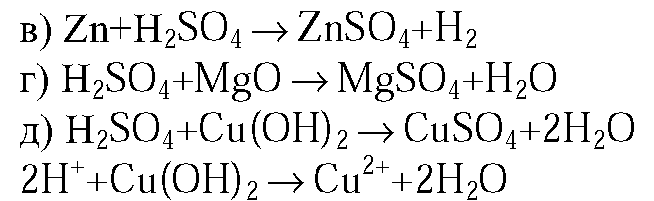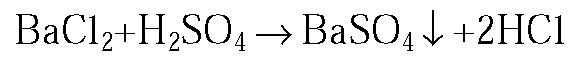Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 1. Кислород. Сера. Серная кислота». Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 1. Кислород. Сера. Серная кислота».
|
Условие задачи: Вариант 2
Вопросы:
1. Составьте уравнения реакций: а) серы с углем; б) серы с алюминием (укажите степени окисления атомов и расставьте коэффициенты с помощью метода электронного баланса); в) раствора серной кислоты с цинком; г) раствора серной кислоты с оксидом магния; д) раствора серной кислоты с раствором гидроксида калия (в молекулярной и ионной формах).
2. В каком виде сера встречается в природе? Охарактеризуйте области применения серы.
3. В одной пробирке находится раствор серной кислоты, а в другой — соляная кислота. Как можно распознать эти растворы? Напишите уравнения соответствующих реакций.
Ответы и решения:
1.
2. В природе сера встречается в самородном виде, в составе сульфатов и сульфидов. Основные области применения: для производства серной кислоты, вулканизации каучука, в органическом синтезе.
3. Прилив в обе пробирки раствор хлорида бария, в одной пробирке наблюдает выпадение белого осадка.