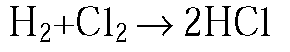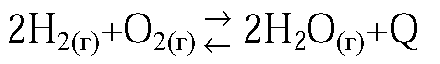Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 2. Скорость химических реакций. Химическое равновесие.». Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 2. Скорость химических реакций. Химическое равновесие.».
|
Условие задачи: Вариант 2
Вопросы:
1. Охарактеризуйте на конкретных примерах зависимость скорости химических реакций от концентрации реагирующих веществ.
2. В какую сторону сместится равновесие реакции
2H2(г) + O2(г) 2H2O(г) + Q а) при понижении температуры; б) при увеличении давления? Дайте обоснованный ответ.
Ответы и решения:
1.
Если концентрация этих веществ мала, то реакция идет медленно, если концентрация достаточно велика, то реакция происходит мгновенно, со взрывом.
2.
а) вправо, т. к. реакция экзотермична;
б) вправо, т. к. реакция протекает с уменьшением объема системы.