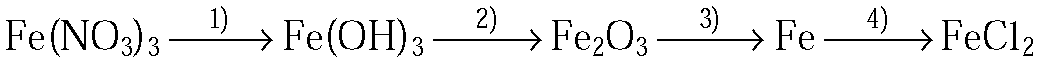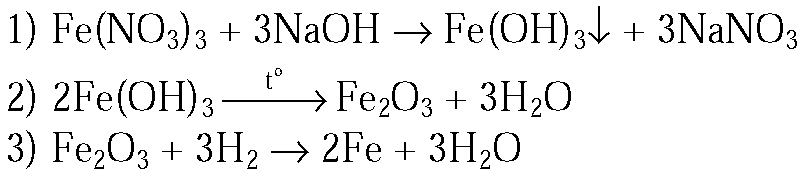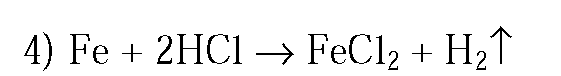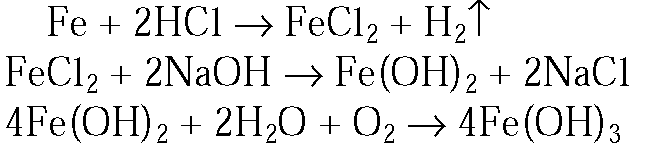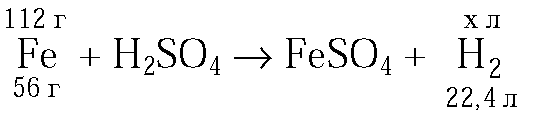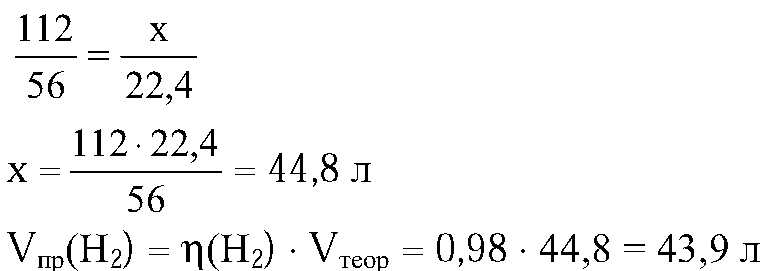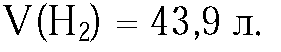Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема VI. Железо. Металлургия. Работа 1. Железо и его соединения». Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема VI. Железо. Металлургия. Работа 1. Железо и его соединения».
|
Условие задачи: Вариант 2
Вопросы:
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Fe(NO3)3 → Fe(OH)3 → Fe2O3 → Fe → FeCl2
2. Какие свойства — окислительные или восстановительные — проявляют соединения железа со степенью окисления +2? Почему?
3. Как, исходя из металлического железа, можно получить гидроксид железа(II) и гидроксид железа(III)? Приведите уравнения реакций.
4. Смесь железа и железной окалины Fe3O4 массой 32 г обработали избытком соляной кислоты. При этом выделилось
5,6 л водорода (н. у.). Рассчитайте массовую долю железа и железной окалины в смеси. (Ответ: 43,75% Fe и 56,25% Fe3O4.)
Ответы и решения:
1.
2. Соединения железа со степенью окисления +2 проявляют восстановительные свойства, при этом окисляясь до степени окисления +3, т. к. их атом при этом переходит в более устойчивую форму. В некоторых случаях эти соединения могут проявлять окислительные свойства, когда из них вытесняется металлическое железо.
3.
4.
Ответ: