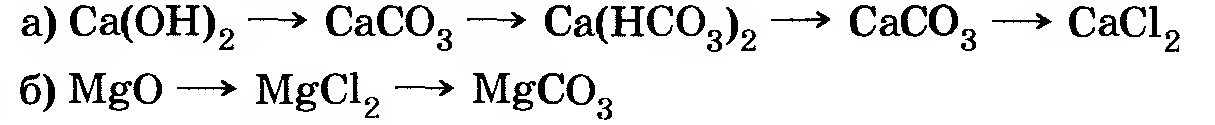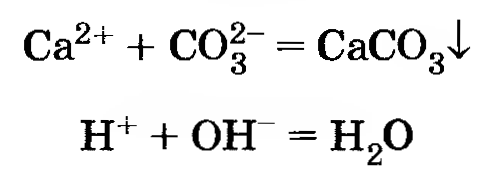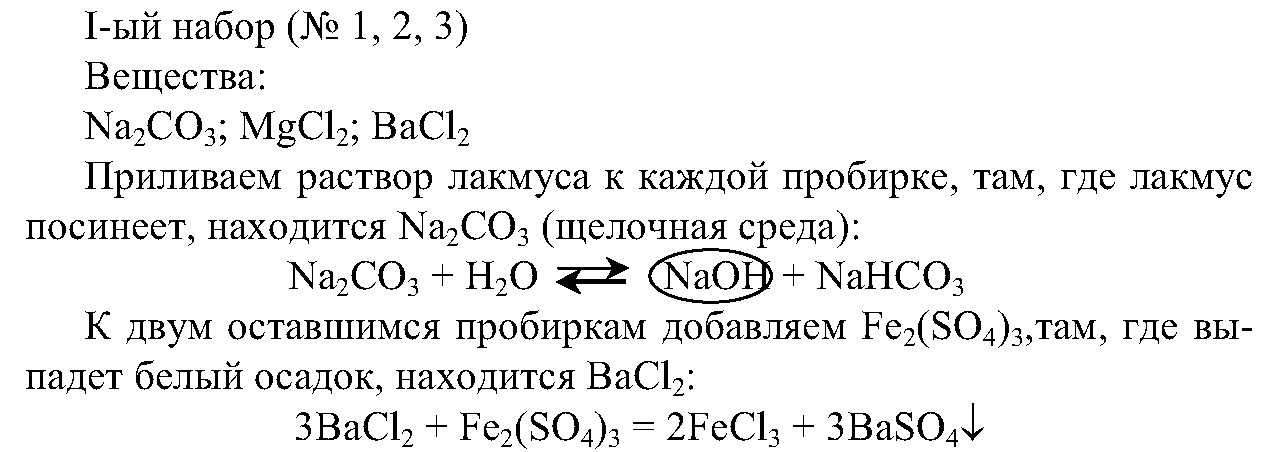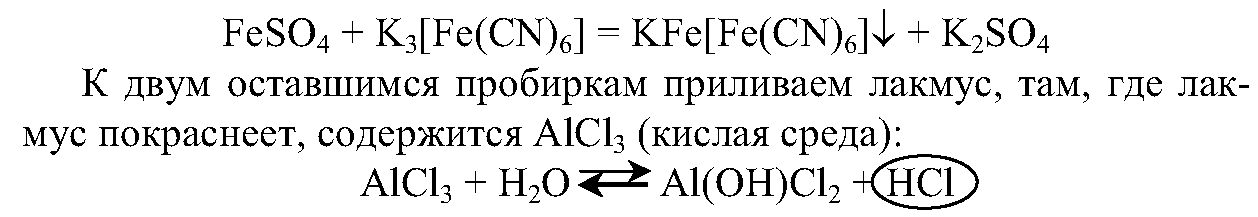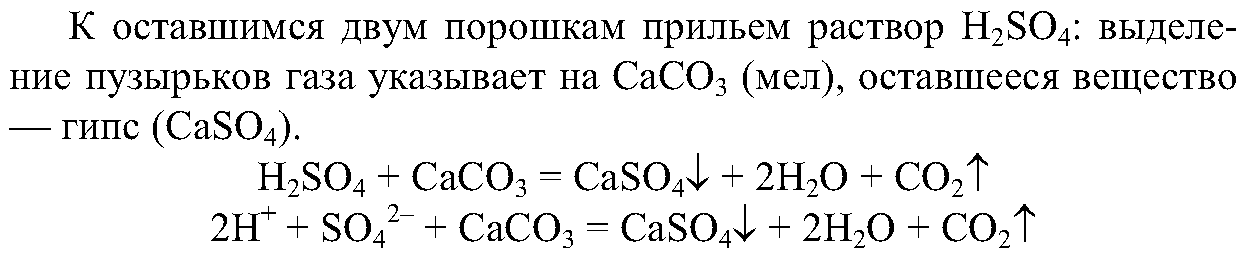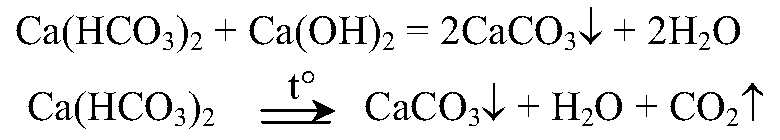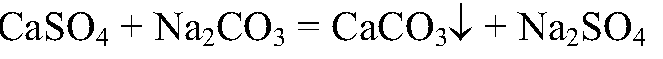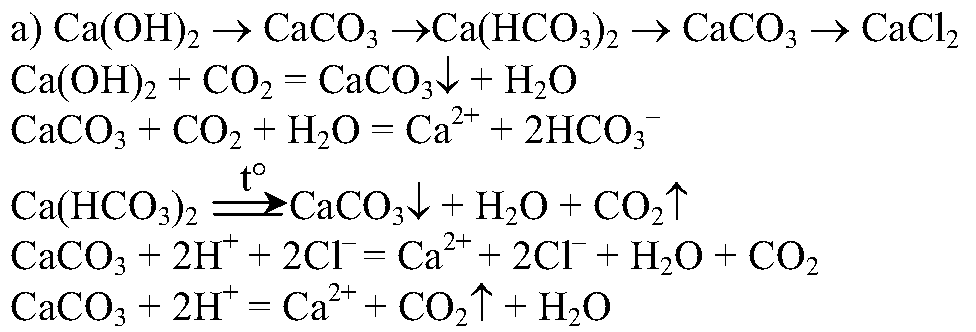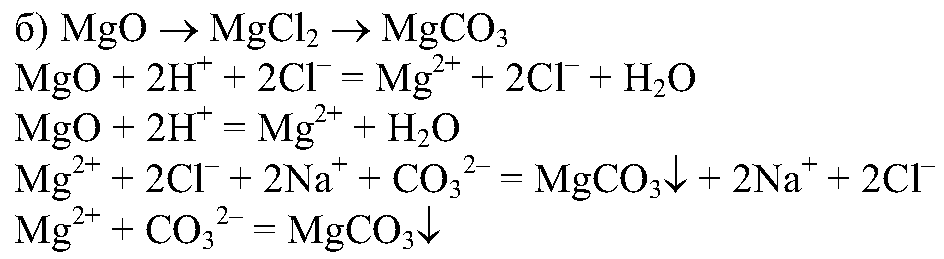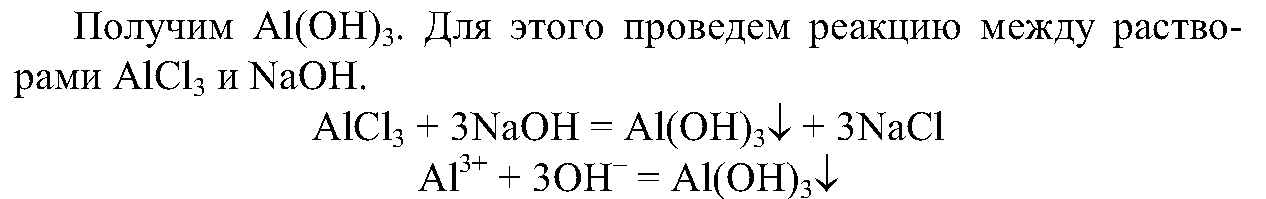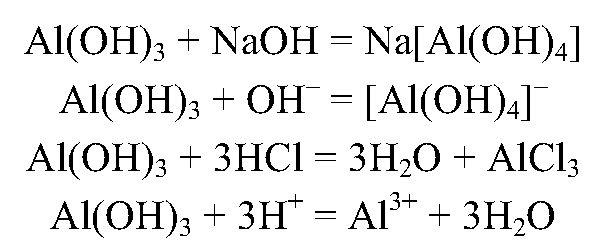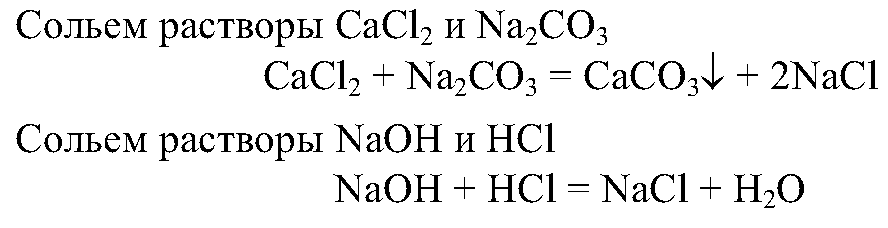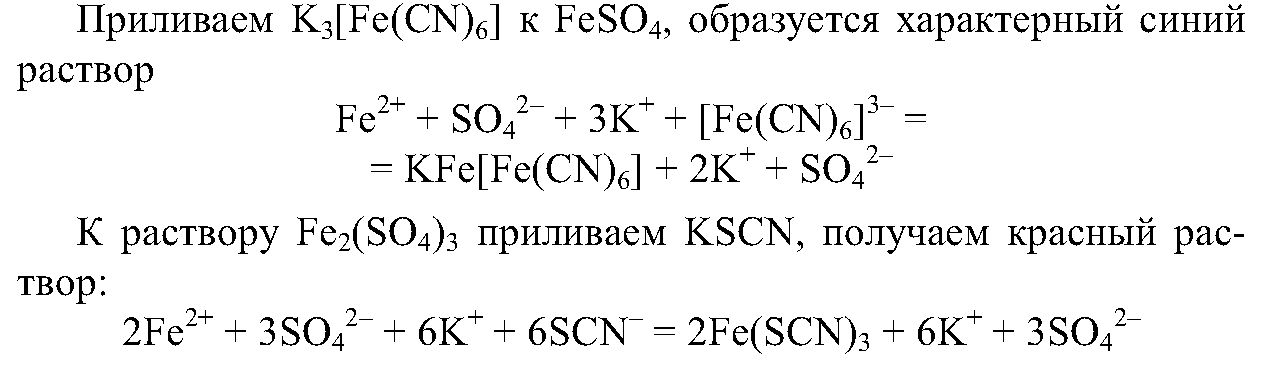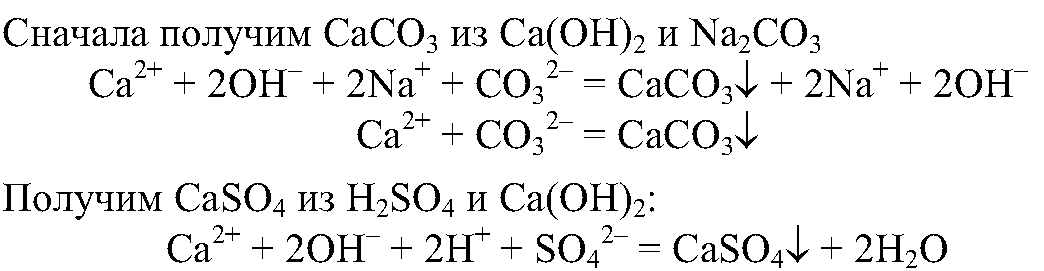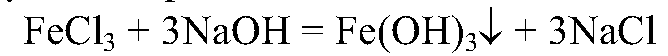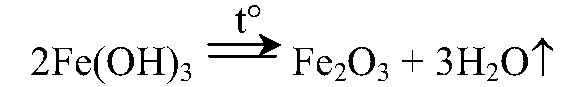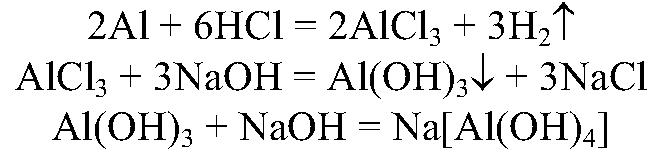 Решебник по химии за 9 класс (Л. С.Гузей, В. В.Сорокин, Р. П.Суровцева, 2000 год), №10 к главе «Практические занятия». Решебник по химии за 9 класс (Л. С.Гузей, В. В.Сорокин, Р. П.Суровцева, 2000 год), №10 к главе «Практические занятия».
|
Условие задачи: Практическое занятие № 10. Решение экспериментальных задач по разделу «Металлы»
Оборудование. Штатив с пробирками, прибор для получения газов (заправленный для получения углекислого газа), голубой светофильтр, спиртовка (горелка), спички.
Вещества. Алюминий, известковая вода, 10% — е растворы гидроксида натрия, серной, соляной, азотной кислот, сульфатов железа (III) и магния, карбоната натрия, хлоридов железа (III), алюминия и бария, 1%-й раствор нитрата серебра, 5%-е растворы красной кровяной соли K3[Fe(CN)6] и желтой кровяной соли K4[Fe(CN)6], раствор лакмуса, оксид магния, мел, сода, гипс, набор из растворов карбоната натрия, хлорида магния, хлорида бария — соответственно пробирки № 1, № 2, № 3, набор из растворов хлорида калия, хлорида кальция, карбоната натрия — соответственно пробирки № 4, № 5, № 6, набор из растворов хлорида алюминия, хлорида бария, сульфата железа (II) — соответственно пробирки № 7, № 8, № 9, набор порошков из соды, мела, гипса, жесткая вода (две колбы), дистиллированная вода (в стакане).
Примеры экспериментальных задач
1. Вы имеете три набора растворов: первый набор — пробирки № 1, № 2, № 3, второй набор — пробирки № 4, № 5, № 6 и третий набор — пробирки № 7, № 8, № 9.
Составьте план анализа веществ в наборах и проведите реакции их распознавания. Напишите уравнения проведенных вами реакций.
2. Вам выдан набор порошков — мел, сода, гипс. Составьте план анализа веществ и проведите реакции для их распознавания. Дайте мотивированное объяснение выбранным вами реакциям и запишите их ионные уравнения.
3. Вы имеете две колбы с водой, содержащей соли временной жесткости (в одной колбе) и соли постоянной жесткости (в другой колбе). Установите характер жесткости каждого образца воды. Напишите уравнения реакций, которые вы провели для определения солей жесткости.
4. Проведите реакции, с помощью которых можно осуществить следующие превращения:
Напишите полные и сокращенные ионные уравнения соответствующих реакций.
5. Получите с помощью имеющихся в вашем распоряжении реактивов гидроксид алюминия и экспериментально докажите его амфотерность.
Запишите ионные уравнения соответствующих реакций.
6. Проведите реакции, которые выражены следующими сокращенными ионными уравнениями:
7. Проведите реакции, подтверждающие качественный состав сульфата железа (II) и хлорида железа (III). Напишите ионные уравнения проделанных реакций.
8. Получите с помощью реакций обмена карбонат и сульфат кальция, используя для этого растворы гидроксида кальция, серной кислоты и карбоната натрия. Напишите полные и сокращенные ионные уравнения проведенных реакций.
9. Из хлорида железа (III) получите оксид железа (III). Напишите уравнения проведенных реакций.
10. Исходя из алюминия, получите его хлорид, гидроксид и алюминат. Напишите уравнения осуществимых реакций.
1.
2.
Сначала растворим порошки в воде, из 3-х порошков растворится только сода.
3.
Временная жесткость:
Устранение постоянной жесткости:
4.
Проведем несколько реакций:
5.
6.
7.
8.
9.
Сначала получим гидроксид железа:
Осадок отфильтруем и прокалим:
10.
Алюминий растворим в кислоте, затем осадим его гидроксид, затем с избытком щелочи получим растворимый комплекс.