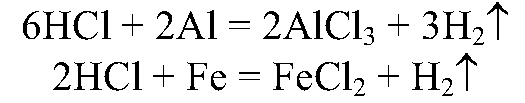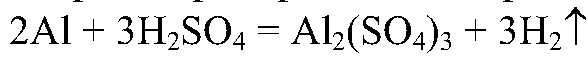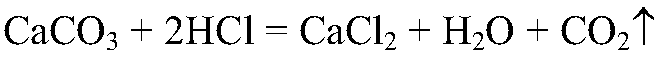 Решебник по химии за 9 класс (Л. С.Гузей, В. В.Сорокин, Р. П.Суровцева, 2000 год), №2 к главе «Практические занятия». Решебник по химии за 9 класс (Л. С.Гузей, В. В.Сорокин, Р. П.Суровцева, 2000 год), №2 к главе «Практические занятия».
|
Условие задачи: Практическое занятие № 2. Изучение влияния условий на скорость химических реакций
Задание. Экспериментально изучите зависимость скорости химических реакций от природы реагирующих веществ, их концентрации, температуры, поверхности соприкосновения веществ и наличии катализатора.
Соблюдайте правила техники безопасности при работе с кислотами и при нагревании веществ!
Оборудование. Штатив с пробирками, нагревательный прибор.
Вещества. Кислоты: соляная (10%-я), серная (20% — я); металлы: медь, железо, цинк, алюминий (в виде узких пластинок, кусочков проволоки, гранул); вода, кусочки мрамора и равная им по массе мелкая крошка мрамора, раствор медного купороса.
Выполнение работы
1. В две пробирки налейте по 2 мл соляной кислоты и опустите в одну пробирку алюминий, в другую железо. Наблюдайте за скоростью выделения водорода. Сделайте вывод о зависимости скорости химической реакции от природы реагирующих веществ.
2. В одну пробирку налейте 2 мл серной кислоты, в другую — 1 мл серной кислоты и 1 мл воды. Опустите в каждую пробир
ку алюминий. Наблюдайте за скоростью выделения водорода. Сделайте вывод о зависимости скорости химической реакции от концентрации кислот.
3. В две пробирки налейте по 2 мл серной кислоты, опустите в них алюминий в одинаковых количествах. Содержимое одной из пробирок нагрейте. В какой пробирке реакция идет быстрее? Почему?
4. В две пробирки налейте в равных объемах соляную кислоту (не более 1/4 объема пробирки). Поместите одновременно в одну из пробирок кусочек мрамора, в другую — равную по массе мраморную крошку.
Наблюдайте, в какой из пробирок реакция закончится раньше. Почему? Сделайте вывод о зависимости скорости химической реакции от поверхности соприкосновения реагирующих веществ.
5. В две пробирки налейте по 2 мл серной кислоты и поместите в них одинаковое количество (равное по массе) алюминия. Добавьте в одну из пробирок несколько капель раствора медного купороса.
Что вы наблюдаете? Как образовавшаяся медь влияет на скорость химической реакции? Как называются ускоряющие химические реакции вещества?
6. На основании проведенных опытов сделайте вывод об условиях, влияющих на скорость химических реакций.
1.
Водород выделяется активнее в пробирке с алюминием.
Вывод: чем активнее металл, тем быстрее идет реакция.
2.
Реакция идет быстрее в пробирке с 2 мл серной кислоты.
Вывод: чем больше концентрация, тем больше скорость реакции.
3.
Быстрее идет реакция в нагретой пробирке.
Вывод: с увеличением температуры реакция идет быстрее.
4.
С мраморной крошкой реакция идет быстрее, т. е. закончится раньше:
Вывод: чем больше поверхность соприкосновения реагирующих веществ, тем выше скорость реакции.
5.
В пробирке, в которую добавили CuSO4, реакция идет быстрее, т. к. образующаяся из медного купороса медь играет роль катализатора.
Вещества, увеличивающие скорость реакции, но сами в реакцию не вступающие, называются катализаторами.
6.
Условия, влияющие на скорость реакции:
— природа реагирующих веществ;
— концентрация реагирующих веществ;
— температура, при которой протекает реакция;
— поверхность соприкосновения реагирующих веществ;
— вещества, ускоряющие реакцию, — катализаторы.