Лабораторная работа №7
Лабораторная работа № 7 «Определение заряда электрона»
Цель работы: научиться определять заряд электрона экспериментальным путем.
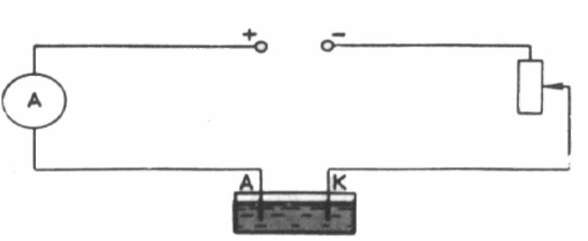
Схема измерительной установки показана на рисунке.
Для проведения эксперимента можно использовать водный раствор сульфата меди (CuSO4), а в качестве электродов — медные пластины. Заряд электрона может быть определен по формуле:
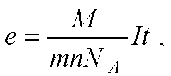
Полученной из закона Фарадея для электролиза. Здесь M — масса выделившегося на электроде вещества, М — молярная масса вещества, N — валентность этого вещества, NA — постоянная Авогадро, I — сила тока, прошедшего через раствор электролита, T — время прохождения тока.
Масса выделившейся на катоде меди определяется путем взвешивания катода до и после проведения опыта. Поэтому M=m2+m1, и формула для определения заряда электрона примет вид:
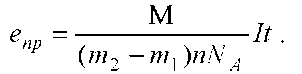
Для измерения силы тока используют школьный амперметр, время измеряется часами. Реостат в цепи необходим для регулирования силы тока.
Пример выполнения
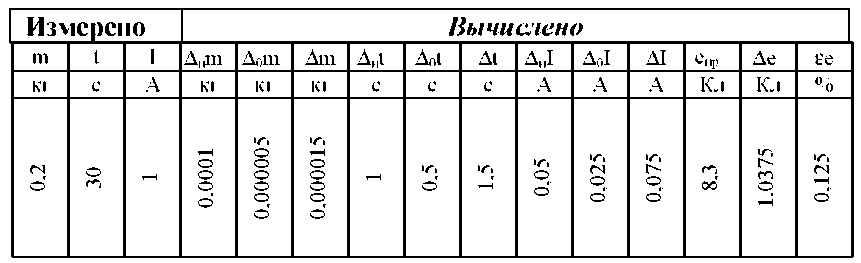
Используем следующие формулы для заполнения таблицы:
1) Δиm — абсолютная погрешность
Δиm = 0,00001 кг
Δ0m — абсолютная погрешность отсчета
Δ0m = 0,000005 кг
Δm — максимальная абсолютная погрешность
Δm = Δиm + Δ0m = 0,00001 + 0,000005 = 0,000015 кг
2) Δиt = 1
Δ0t = 0,5
Δt = Δиt + Δ0t = 1 + 0,5 = 1,5
3) ΔиI = 0,05
Δ0I = 0,025
ΔI = ΔиI + Δ0I = 0,05 + 0,025 = 0,075
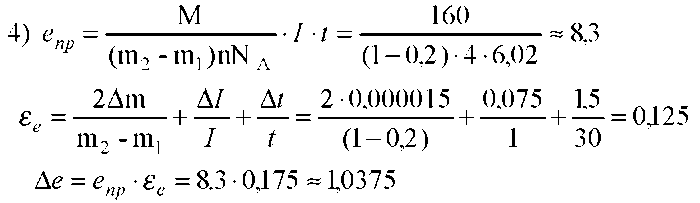
Вывод: на опыте с помощью приборов и инструментов удалось экспериментально вычислить заряд электрона.
