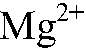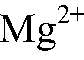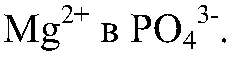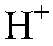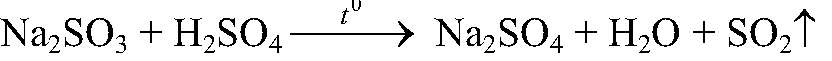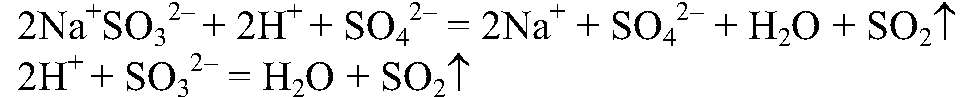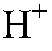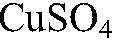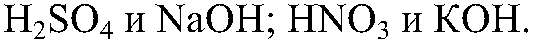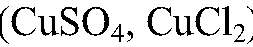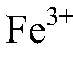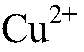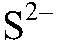Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы».
|
Условие задачи: Практическая работа № 1 стр. 22 Решение экспериментальных задач по теме «Электролитическая диссоциации»
1) Действия: К кусочку цинка добавляем 1 мл концентрированной серной кислоты. Наблюдения: Выделяется осадок желтого цвета. Уравнения реакции:
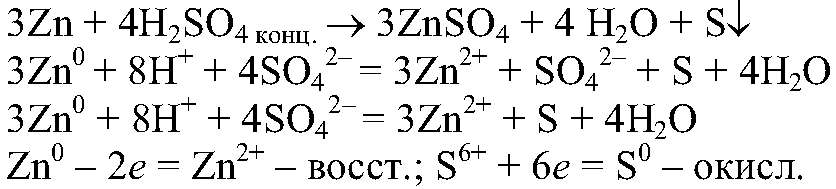
Выводы: Концентрированная серная кислота проявляет окислительные свойства, поэтому при взаимодействии с металлами водород в свободном состоянии не выделяется. 2) а) Действия: К раствору хлорида магния добавляем р-р
Наблюдения: Образуется белый осадок.
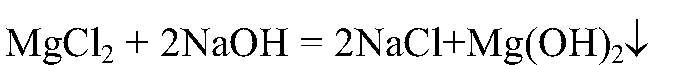
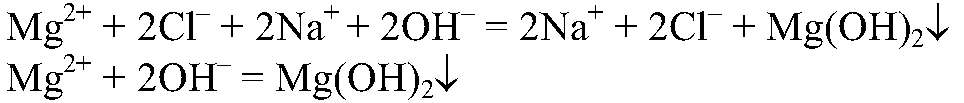
Выводы: Реакция обмена идет до конца, т. к. происходит связывание ионов
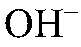
в нерастворимое основание. б) Действия: К раствору хлорида магния добавляем раствор
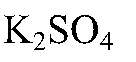
Наблюдения: Изменений нет. Уравнения реакции:
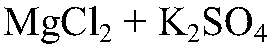
— реакция не происходит. Выводы: Реакция не идет, связывания ионов не происходит. в) Действия: К раствору хлорида магния добавляем р-р
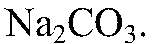
Наблюдения: Выпадает белый осадок. Уравнения реакции:
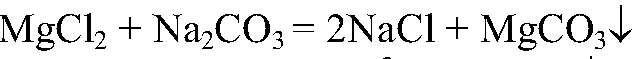
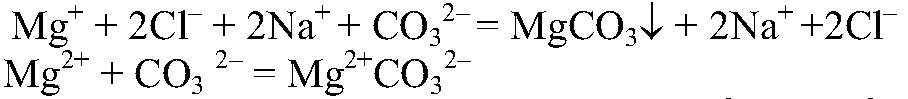
Выводы: Реакция сопровождается связыванием ионов
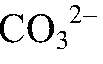
поэтому идет до конца. г) Действия: К раствору хлорида магния добавляем р-р
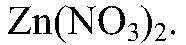
Наблюдения: Изменений нет. Уравнения реакции:
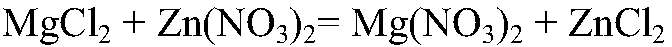
Выводы: Реакция не идет, т. к. связывания ионов не происходит. д) Действия: К раствору хлорида магния добавляем раствор
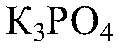
Наблюдения: Образуется белый осадок. Уравнения реакции:
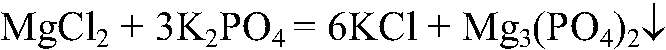
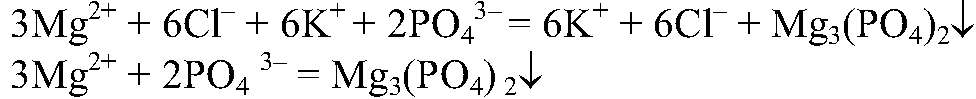
Выводы: Реакция сопровождается связыванием ионов
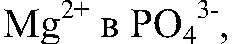
поэтому идет до конца. е) Действия: К раствору хлорида магния добавляем раствор
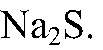
Наблюдения: Образуется белый осадок. Уравнения реакции:
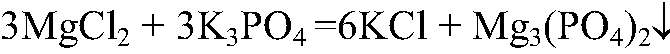
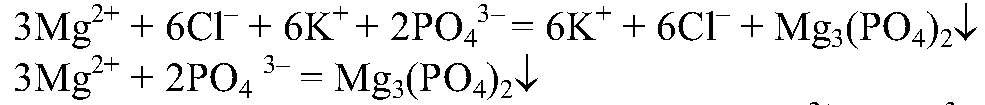
Выводы: Реакция сопровождается связыванием ионов
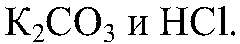
Наблюдения: Выделяется газ без запаха. Уравнения реакции:
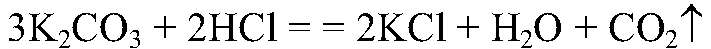
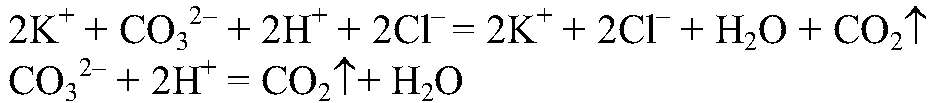
Выводы: Реакция идет до конца, т. к. происходит связывание ионов
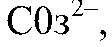
образуется малодиссоциирующее вещество. б) Действия: Даны растворы
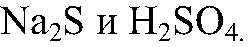
Наблюдения: Выделяется газ с неприятным запахом. Уравнения реакции:
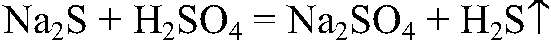
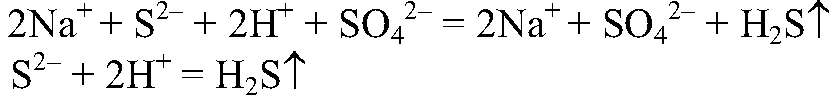
Выводы: В реакции происходит связывание ионов, поэтому реакция идет до конца и сопровождается выделением газа. в) Действия: Даны растворы
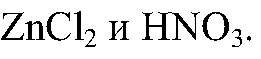
Наблюдения: Изменений нет. Уравнения реакции:
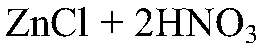
— реакция не происходит. Выводы: Связывания ионов не происходит. г) Действия: Даны растворы
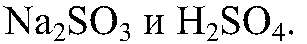
Наблюдения: Выделяется газ с резким запахом. Уравнения реакции:
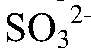
связываются с образованием газа и малодиссоциирующего вещества, поэтому реакция идет до конца. д) Действия: Даны растворы
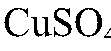
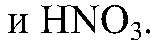
Наблюдения: Изменений нет. Уравнения реакции:
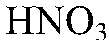
— реакция не происходит. Выводы: Реакция не идет, т. к. связывания ионов не происходит. 4) Осуществить реакцию: а) Действия: Используем
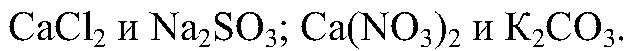
Наблюдения: Образуется белый осадок. Уравнения реакции:
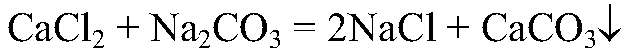
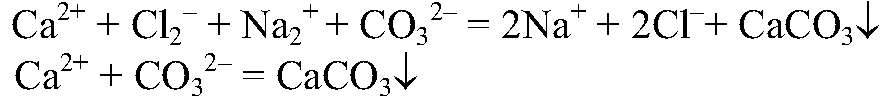
Выводы: Реакция сопровождается образованием осадка, поэтому идет до конца. б) Действия: Используем
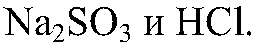
Наблюдения: Выделяется газ с резким запахом. Уравнения реакции:
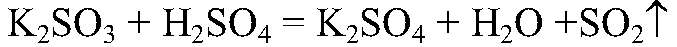
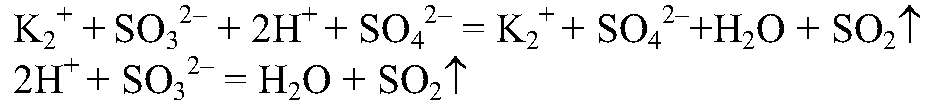
Выводы: Реакция сопровождается образованием газа и малодиссоциирующего вещества, поэтому реакция идет до конца. в) Действия: Используем раствор любой щелочи и любой кислоты, например,
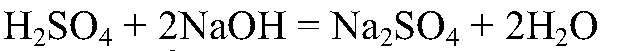
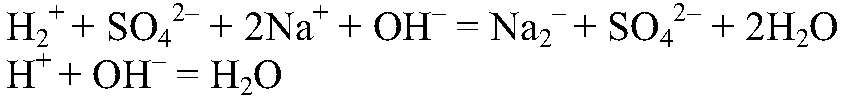
Выводы: В результате реакции образуется малодиссоциирующее вещество, поэтому реакция идет до конца. г) Действия: Можно использовать алюминий и одну из кислот:
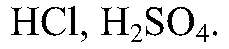
Наблюдения: Выделяется газ без запаха. Уравнения реакции:
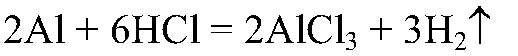
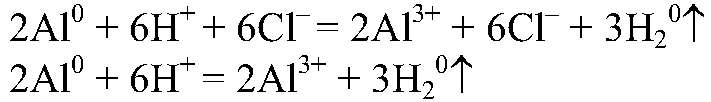
Выводы: В результате реакции происходит окисление атомов алюминия ионами водорода. д) Действия: Можно использовать одну из растворимых солей меди
Наблюдения: На железных стружках появляется медный налет, раствор постепенно желтеет. Уравнения реакции:
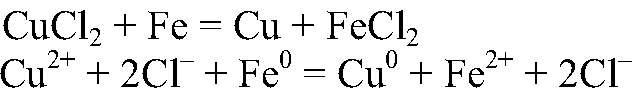
Выводы: Входе реакции происходит восстановление ионов меди атомами железа. е) Действия: Можно использовать кислоту
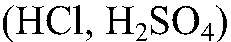
и металлы, стоящие в ряду напряжений до водорода. Наблюдения: Выделяется газ без запаха. Уравнения реакции:
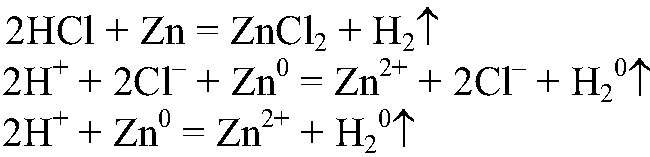
Выводы: Происходит восстановление ионов
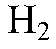
атомами цинка. 5) Проводим реакции: а) Действия: Проводим реакции между сероводородной и хлорной водой. Наблюдения: При смешивании сероводородной и хлорной воды их характерный запах исчезает. Уравнения реакции:
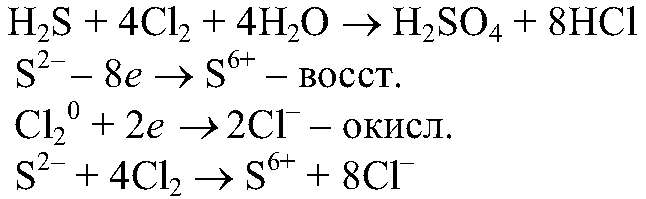
Выводы: В результате данной реакции хлор проявляет окислительные свойства, а сероводород, за счет серы в низшей степени окисления, восстановительные. б) Действия: Проводим реакции между раствором иодида калия и хлорной водой. Наблюдения: Появляется коричневое окрашивание раствора. Уравнения реакции:
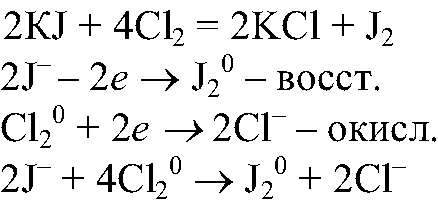
Выводы: В данной реакции хлор также проявляет окислительные свойства и окисляет ионы йода. в) Действия: Проводим реакции между соляной кислотой и
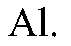
Наблюдения: Выделяется газ без цвета и запаха. Уравнения реакции:
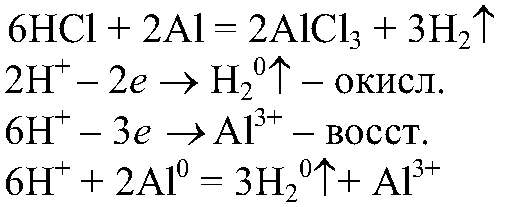
Выводы: Ионы водорода окисляют атомы алюминия. г) Действия: Проводим реакции между концентрированной серной кислотой и медью при нагревании. Наблюдения: Выделяется газ с резким запахом, раствор приобретает синюю окраску. Уравнения реакции:
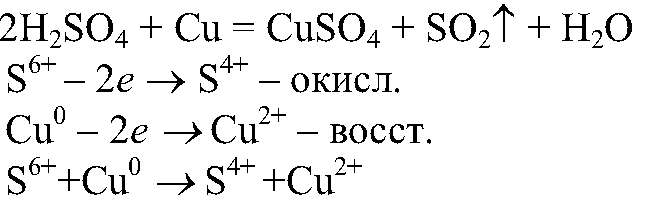
Выводы: Концентрированная серная кислота проявляет окислительные свойства за счет кислотного остатка. 6) Необходимые вещества можно получить, например, так: а) Действия: К хлориду железа (III) добавляем гидроксид натрия. Наблюдения: Образуется осадок бурого цвета. Уравнения реакции:
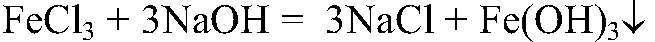
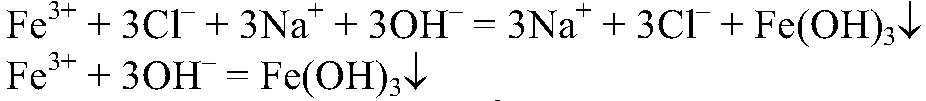
Выводы: В результате связывания ионов
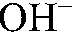
образуется гидроксид железа (III). б) Действия: К сульфату меди (II) добавляем сульфид натрия. Наблюдения: Образуется осадок черного цвета. Уравнения реакции:
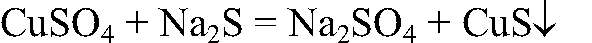
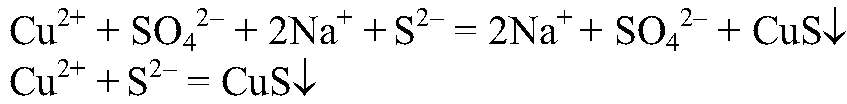
Выводы: В результате связывания ионов
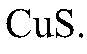
в) Действия: К сульфату натрия приливаем
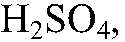
нагреваем. Наблюдения: Выделяется газ с резким запахом. Уравнения реакции:
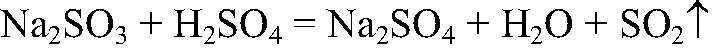
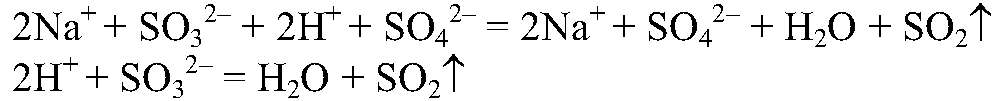
Выводы: В рез-те связывания ионов
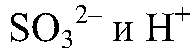
образуется сернистая кислота, которая затем разлагается на оксид серы (IV) и воду. г) Действия: К хлориду магния добавляем карбонат натрия. Наблюдения: Образуется белый осадок. Уравнения реакции:
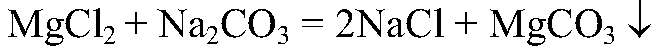
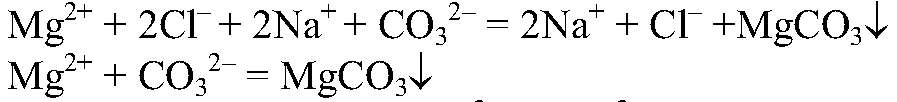
Выводы: В результате связывания ионов
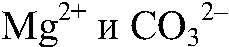
образовалась нерастворимая соль — карбонат магния. д) Действия: К раствору нитрата свинца (II) добавляем цинк. Наблюдения: На цинке появляется черный налет. Уравнения реакции:
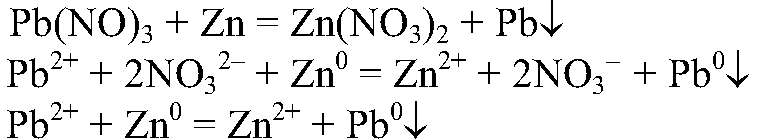
Выводы: Атомы цинка восстанавливают ионы свинца, в результате чего свинец выделяется в свободном состоянии.