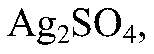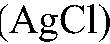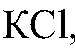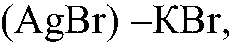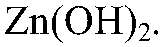Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы».
|
Условие задачи: Практическая работа № 2 стр. 44 Экспериментальные задачи по теме «Подгруппа кислорода»
Задача 1. Различить растворы: а)Na2SO4; б) NaCl; в)H2SO4;
а) Действия: В пробирки со всеми растворами помещаем цинк. Наблюдения: В одной из пробирок происходит выделение газа. Уравнения реакции:
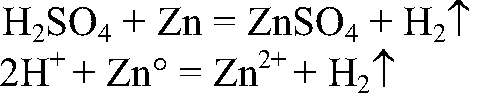
Выводы: В данной пробирке находится раствор серной кислоты, т. к. с металлом с выделением водорода может взаимодействовать только кислота. б) Действия: К оставшимся растворам добавляем хлорид бария. Наблюдения: В одной из пробирок образуется белый осадок. Уравнения реакции:
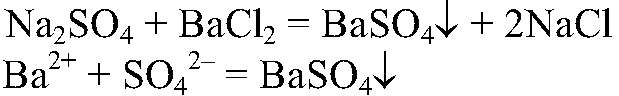
Выводы: В данной пробирке находится сульфат натрия. в) Действия: К оставшемуся раствору добавляем нитрат серебра. Наблюдения: Образуется белый осадок. Уравнения реакции:
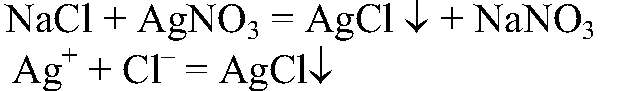
Выводы: В данной пробирке находится хлорид натрия, т. к. проведенная реакция является качественной на хлорид-ион. Примечание: В случае сульфата образуется малорастворимая соль
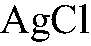
поэтому нельзя изменять последовательность в определении сульфата и хлорида.
Задача 2. Из сульфата меди (II) получить хлорид меди (II).
а) Действия: К раствору сульфата меди (II) добавляем щелочь. Наблюдения: Образуется синий осадок. Уравнения реакции:
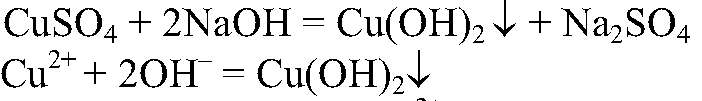
Выводы: В результате связывания ионов
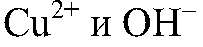
образуется нерастворимое основание, которое взаимодействует с кислотой. б) Действия: К полученному осадку добавляем соляную кислоту. Наблюдения: Осадок растворяется.
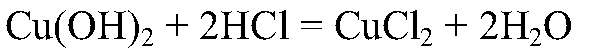
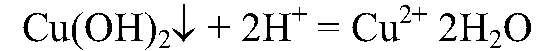
Выводы: В результате связывания ионов
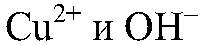
образуется нерастворимое основание, которое взаимодействует с кислотой.
Задача 3. С помощью характерных реакций различить: KJ, K2SO4,KBr;
а) Действия: Ко всем растворам добавляем хлорид бария. Наблюдения: В одной из пробирок образуется белый осадок. Уравнения реакции:
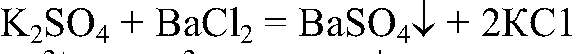
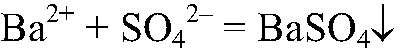
Выводы: В данной пробирке находится сульфат калия, т. к. данная реакция — качественная на сульфат ион. б) Действия: К оставшимся р-рам добавляем нитрат серебра (I). Наблюдения: В одной пробирке образуется белый осадок, в другой — светло-желтый, а в третьей — желтый. Уравнения реакции:
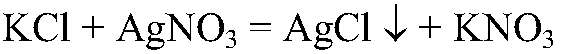
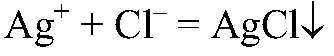
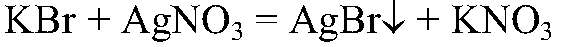
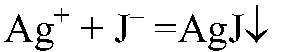
Выводы: В пробирке с белым осадком
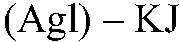
Реакция с нитратом серебра (I) — качественная на ионы галогенов.
Задача 4. Осуществить превращение: а) Zn → ZnSO4 → Zn(OH)2
1) Действия: К нескольким кусочкам цинка добавляем разбавленную серную кислоту. Уравнения реакции:
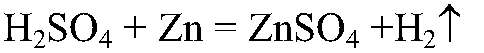
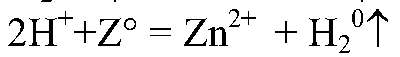
2) Действия: Через некоторое время добавляем щелочь. Уравнения реакции:
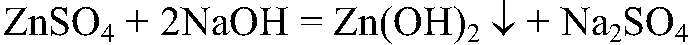
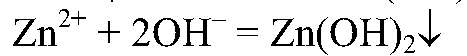
б) CuO → CuSO4 Действия: К оксиду меди (II) добавляем раствор серной кислоты, нагреваем. Уравнения реакции:
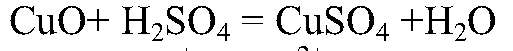
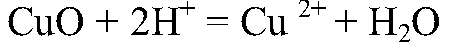
в) Zn → ZnCl2 → Zn(OH)2 1) Действия: К кусочкам цинка добавляем соляную кислоту Уравнения реакции:
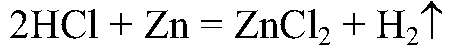
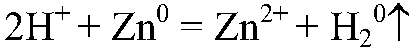
2) Действия: Через некоторое время добавляем щелочь. Уравнения реакции:
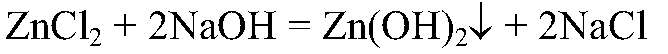
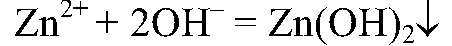
Выводы: В результате связывания ионов
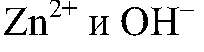
образуется нерастворимое основание
Задача 5. Даны вещества: H2SO4, Zn, Ba(NO3)2, NaCl, CaCl2, CuCl2. Какие из веществ реагируют с H2SO4?
1) Действия:
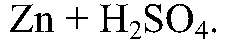
Наблюдения: Выделяется газ. Уравнения реакции:
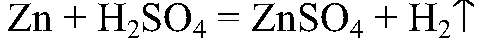
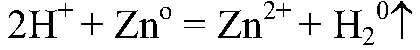
Выводы: Поэтому цинк реагирует с серной кислотой. 2) Действия:
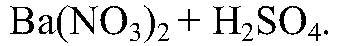
Наблюдения: Образуется белый осадок. Уравнения реакции:
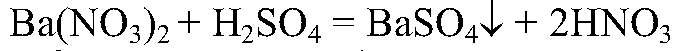
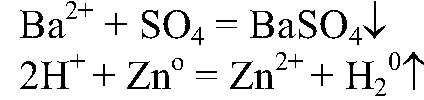
Выводы: Это реакция обмена, т. к. происходит связывание ионов
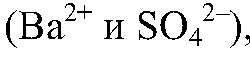
реакция идет до конца. 3) Действия:
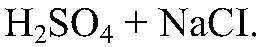
Наблюдения: Изменений нет. Уравнения реакции:
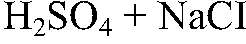
— не реагирует. Выводы: Реакции нет. 4) Действия:
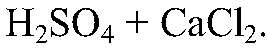
Наблюдения: Раствор мутнеет. Уравнения реакции:
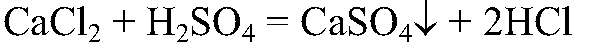
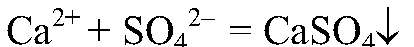
Выводы: Серная кислота реагирует с хлоридом кальция. 5) Действия:
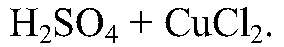
Наблюдения: Изменений нет. Уравнения реакции:
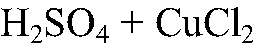
— не реагирует. Выводы: Реакции нет.
Задача 6. Провести реакции, подтверждающие качественный состав серной и соляной кислот.
а) Подтверждаем состав серной кислоты. 1) Действия: В раствор серной кислоты опускаем кусочек цинка. Наблюдения: Выделяется газ. Уравнения реакции:
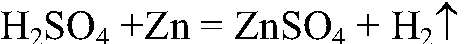
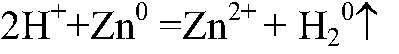
Выводы: Т. к. при взаимодействии с цинком происходит выделение водорода в свободном состоянии, значит, в состав серной кислоты входит водород. 2) Действия: К раствору серной кислоты добавляем раствор хлорида бария. Наблюдения: Образуется белый осадок. Уравнения реакции:
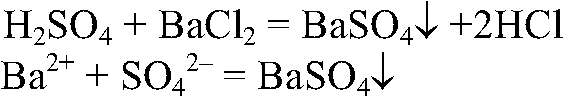
Выводы: Эта реакция — качественная на сульфат-ион,
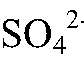
значит, в серной кислоте есть сульфат-ион. б) Подтверждаем качественный состав соляной кислоты. 1) Действия: Берем несколько кусочков цинка и добавляем соляную кислоту. Наблюдения: Выделяется газ. Уравнения реакции:
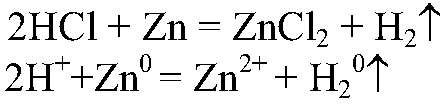
Выводы: Т. к. при взаимодействии с цинком выделяется
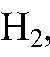
значит, в состав соляной кислоты входит водород. 2) Действия: К раствору соляной кислоты добавляем раствор нитрата серебра (I). Наблюдения: Образуется белый осадок. Уравнения реакции:
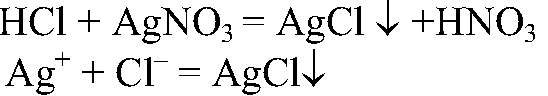
Выводы: Эта реакция является качественной на хлорид-ион, значит, он имеется в соляной кислоте.