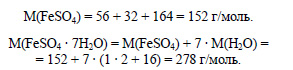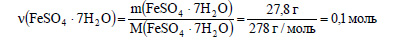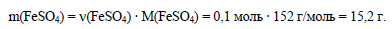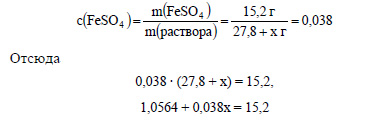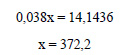Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №2 к главе «Глава III. Строение вещества». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №2 к главе «Глава III. Строение вещества».
|
Условие задачи: В какой массе воды нужно растворить 27,8 г кристаллогид — рата сульфата железа (II) FeSО4 · 7H2O, чтобы получить 3,8%-ный раствор сульфата железа (II) FeSO4?
Вычислим молярные массы сульфата железа и его кристаллогидрата:
Вычислим количество вещества кристаллогидрата:
В 1 моль кристаллогидрата содержится 1 моль сульфата железа, значит в 0,1 моль кристаллогидрата содержится 0,1 моль сульфата железа. Вычислим массу сульфата железа:
Пусть для получения раствора с массовой долей 3,8%, или 0,038, нужно прибавить к кристаллогидрату сульфата железа х г воды. Масса раствора будет равна 27,8 + х г, а масса растворенного вещества (сульфата железа) – 15,2 г. Составим уравнение:
Ответ: нужно растворить кристаллогидрат в 372,2 мл воды.