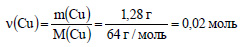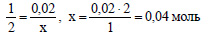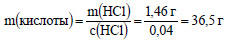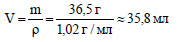Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №5 к главе «Глава V. Металлы». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №5 к главе «Глава V. Металлы».
|
Условие задачи: Вещество, полученное при прокаливании 1,28 г меди в струе кислорода, превратили в хлорид меди (II). Вычислите, какой объем (в мл) 4%-ной соляной кислоты (? = 1,02 г/см3) израсходовали и какова масса выделившегося хлорида меди (II).
Решение:
При прокаливании меди в кислороде образуется оксид меди (II):
2Cu + О2 = 2CuO (1)
При реакции оксида меди (II) с соляной кислотой образуется хлорид меди (II):
СuО + 2НСl = СuСl2 + H2O
Молярная масса меди равна 64 г/моль. Вычислим количество вещества меди:
По уравнению реакции (1) из 2 моль меди образуется 2 моль оксида меди (II), значит из 0,02 моль меди образуется 0,02 моль оксида меди (II). По уравнению (2) 1 моль оксида меди (II) реагирует с 2 моль хлороводорода. Пусть 0,02 моль оксида меди (II) реагирует с х моль хлороводорода. Составим пропорцию:
Определим молярную массу хлороводорода:
М(НСl) = 1 +35,5 = 36,5 г/моль.
Вычислим массу хлороводорода:
m(HCl) = ?(HCl) · M(HCl) = 0,04 моль· 36,5 г/моль = 1,46 г.
Вычислим массу 4%-ной соляной кислоты:
Вычислим объем соляной кислоты:
По уравнению реакции (2) из 1 моль оксида меди (II) образуется 1 моль хлорида меди (II), значит из 0,02 моль оксида меди (II) образуется 0,02 моль хлорида меди (II). Определим молярную массу хлорида меди (II):
М(СuСl2) = 64 + 35,5 · 2 = 135 г/моль.
Вычислим массу хлорида меди (II):
m(CuCl2) = ?(CuCl2) · M(CuCl2) = 0,02 моль · 135 г/моль = 2,7 г.
Ответ: израсходовали 35,8 мл соляной кислоты; образовалось 2,7 г хлорида меди (II).