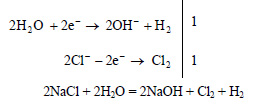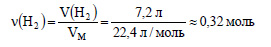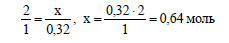Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №2 к главе «Глава V. Металлы». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №2 к главе «Глава V. Металлы».
|
Условие задачи: При электролизе раствора хлорида натрия выделилось 7,2 л водорода (н. у.). Вычислите, сколько по массе и количеству вещества образовалось гидроксида натрия в растворе.
Решение:
Запишем уравнения процессов, происходящих на электродах:
Таким образом, в растворе образуется гидроксид натрия, на катоде выделяется водород, а на аноде хлор.
Вычислим количество вещества выделившегося водорода:
По уравнению реакции на 1 моль выделившегося на катоде водорода приходится 2 моль образовавшегося в растворе гидроксида натрия. Пусть при выделении 0,32 моль водорода в растворе образуется х моль гидроксида натрия. Составим пропорцию:
Определим молярную массу гидроксида натрия:
M(NaOH) = 23 + 16 + 1 = 40 г/моль
Вычислим массу гидроксида натрия:
m(NaOH) = ?(NaOH) · M(NaOH) = 0,64 моль · 40 г/моль = 25,6 г.
Ответ: в растворе образовалось 0,64 моль (25,6 г) гидроксида натрия.