Тепловое равновесие. Макроскопические величины, характеризующие состояние термодинамической системы (в качестве образа можно иметь в виду газ, заключенный в замкнутый объем), — это давление p , объем V , число частиц или число молей n , температура T , внутренняя энергия U и др. Все эти параметры состояния данной термодинамической системы являются величинами, меняющимися в зависимости от ее взаимодействия с окружающей средой.
Рассматриваемая система может быть отделена от окружающей среды или другой системы полностью изолирующей адиабатической перегородкой. В этом случае взаимодействие систем друг с другом полностью отсутствует. Другой предельный случай — диатермическая перегородка , которая совершенно не препятствует тепловому взаимодействию систем.
При тепловом контакте две системы приходят в состояние теплового равновесия .
Две системы находятся в состоянии теплового равновесия, если при контакте через диатермическую перегородку параметры состояния обеих систем не изменяются.
Нулевой закон термодинамики: Две системы, находящиеся в тепловом равновесии с третьей системой, находятся в тепловом равновесии друг с другом.
Температура. По определению две системы, находящиеся в тепловом равновесии, обладают одинаковой температурой.
Термометр — устройство, используемое для измерения температуры данного тела путем сравнения с опорными значениями, условно выбранными за точки отсчета и позволяющими установить шкалу измерений. При этом в разных термометрах используются разные связи между температурой и каким-то наблюдаемым свойством прибора, которое можно считать линейно зависящим от температуры.
В общеизвестном ртутном термометре значение температуры определяется по высоте подъема столбика ртути в капилляре. Градуировка этого термометра использует тот факт, что увеличение объема ртути прямо пропорционально температуре. Наиболее распространена в быту шкала Цельсия, в которой за начало отсчета температуры (0 °С) принимается температура тающего льда, а второй опорной точкой (100 °С) является температура кипения воды при нормальном атмосферном давлении. Интервал между этими опорными точками делится на градусы.
Количество теплоты и теплопередача . Если две системы, находящиеся при разных температурах, привести в тепловой контакт, то между ними происходит передача тепловой энергии, пока не установится тепловое равновесие и температуры не станут одинаковыми. Энергия, переносимая от одной системы к другой только за счет разницы в температурах этих систем, называется количеством теплоты . Принятое обозначение для количества теплоты: Q ,
[Q] = Дж.
Следует помнить, что неправильно говорить о количестве теплоты, содержащейся в системе. Можно говорить только о количестве теплоты, которая добавляется к системе или извлекается из нее.
Существуют три способа передачи количества теплоты от одного тела к другому: теплопроводность , конвекция и излучение . Направление теплообмена определяется разностью температур между телами. Теплота при теплообмене всегда передается от более горячего тела к более холодному.
Температура как мера кинетической энергии молекул газа. В состоянии теплового равновесия температуры двух систем, содержащих некоторые объемы идеальных газов (необязательно одного сорта), по определению одинаковы: 1 = Т 2 . Но, как следует из основного уравнения молекулярно-кинетической теории идеальных газов, в состоянии теплового равновесия должны быть одинаковы средние кинетические энергии молекул газов: <е 1 > = <е 2 > . Действительно, 2/3 = р/n = pV/N , а в состоянии равновесия давления и плотности газов должны быть одинаковы. Это дает возможность выбрать за меру температуры идеального газа.
Высказанная гипотеза проверяется экспериментально. Например, если несколько сосудов, снабженных манометрами и заполненных известными количествами разных газов, поместить в термостат (внешнюю среду, поддерживаемую при постоянной температуре: например, термостатом может быть достаточное количество тающего льда), то отношение pV/N = Q для всех газов будет одинаковым, если только газы достаточно разрежены (близки к идеальным). В принципе, величину Q можно назвать температурой. Заметим, что [ Q ] = Дж , т. е. при таком определении температура измеряется в энергетических единицах.
Абсолютная температура Т вводится определением: Q = kT.
Предельная температура — абсолютный нуль — соответствует обращению в нуль давления идеального газа при фиксированном объеме.
Абсолютная шкала температур (У. Томсон, лорд Кельвин). В абсолютной шкале температур (шкале Кельвина) за нулевую температуру принимается абсолютный нуль T = 0 , а единица температуры (кельвин, К ) совпадает с градусом Цельсия:
1 К = 1 °С .
Связь абсолютной температуры с температурой по Цельсию:
t C = T — 273,15 K .
Коэффициент k в формуле, связывающей температуру в кельвинах Т с температурой в энергетических единицах Q , называется постоянной Больцмана (в честь Л. Больцмана):
k = 1,38 10 -23 Дж/К.
Связь кинетической энергии молекул газа с абсолютной температурой:
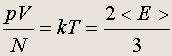 (3.1)
(3.1)
откуда
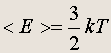 (3.2)
(3.2)
Таким образом, температура есть мера средней кинетической энергии молекул газа .
Удельная теплоемкость, удельная теплота плавления и парообразования. Если тело поглощает определенное количество теплоты d Q и не совершает работы, то температура этого тела растет, поскольку поглощаемая теплота идет на увеличение как средней потенциальной энергии взаимодействия, так и средней кинетической энергии молекул вещества. Эксперимент подтверждает, что при не слишком больших значениях d Q температура тела растет пропорционально количеству теплоты и массе тела. Удельная теплоемкость при постоянном объеме c V — это количество теплоты, которое получает или отдает тело массой 1 кг при изменении его температуры на 1 К . Можно записать:
![]() (3.3)
(3.3)
Для газов следует различать удельную теплоемкость при постоянном объеме c V и удельную теплоемкость при постоянном давлении c p.
Для жидкостей и твердых тел из-за малой их сжимаемости эти две теплоемкости практически совпадают. Молярной теплоемкостью при постоянном объеме C V называют количество теплоты, которое получает или отдает тело, количество вещества в котором равно одному молю, при изменении его температуры на 1 К при постоянном объеме.
Для превращения жидкости в пар необходимо затратить определенное количество теплоты, чтобы разорвать межмолекулярные связи. Температура испаряемой жидкости не меняется, пока вся жидкость не превратится в пар. Это происходит потому, что все подводимое количество теплоты тратится на увеличение потенциальной энергии молекул, которые в жидкости находятся на достаточно близком расстоянии друг от друга и при переходе жидкости в пар после разрыва межмолекулярных связей должны удалиться на значительные расстояния. В результате кинетическая энергия молекул, а следовательно, и температура тела не меняются. Удельной теплотой парообразования r называется количество теплоты, необходимое для превращения 1 кг жидкости в пар при той же температуре . Полное количество теплоты, которое нужно затратить на превращение в пар жидкости массой m, равно
![]() (3.4)
(3.4)
При конденсации пара происходит выделение такого же количества теплоты.
При плавлении кристаллического тела температура также не меняется (разрыв связей между атомами в кристаллической решетке приводит к увеличению их потенциальной энергии). Удельной теплотой плавления l называется количество теплоты, необходимое для превращения 1 кг кристаллического вещества в жидкость при той же температуре . Полное количество теплоты, которое нужно затратить на плавление тела массой m , равно
![]() (3.5)
(3.5)
При обратной кристаллизации тела выделяется такое же количество теплоты.
