Уравнение состояния идеального газа. Основное уравнение молекулярно-кинетической теории газа с учетом определения абсолютной температуры принимает вид:
![]() или
или ![]()
Пусть масса рассматриваемого газа в объеме V равна m , а масса отдельной молекулы m 0 . Тогда
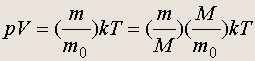
где M — молярная масса. По определению m/M = n , а M/m 0 = N A . Поэтому
![]()
где введена универсальная газовая постоянная
R = kN A = 8,31 Дж/(моль·К) .
Итак, справедливо уравнение
состояния, связывающее давление, объем и
температуру идеального газа:
![]() (уравнение Менделеева-Клапейрона).
(уравнение Менделеева-Клапейрона).
Из этого уравнения следует, что параметры двух произвольных состояний 1 и 2 идеального газа связаны между собой:
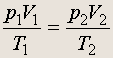
![]() (4.1)
(4.1)
Диаграммы состояния . Если переход между состояниями системы с разными значениями p, V, T (для определенности можно все время иметь в виду состояние идеального газа) происходит так медленно, что в каждый данный момент времени систему можно считать находящейся в равновесии с окружающей средой, то такой переход называется квазистатическим. Удобно изображать квазистатические процессы на
pV -диаграмме. Каждой точке этой диаграммы отвечает определенное состояние системы с данными значениями p, V, T . Квазистатический процесс перехода из одного состояния в другое изображаетсянепрерывной линией на pV -диаграмме.
Газовые законы
1. При постоянной температуре T = const (изотермический процесс)
pV = const .(закон Р. Бойля и Э. Мариотта).
2. При постоянном давлении р = const (изобарический процесс)
V/T = const . (закон Ж. Гей-Люссака).
3. При постоянном объеме V = const (изохорический процесс)
p/T = const . (закон Ж. Шарля).
4. Процесс, происходящий в теплоизолированной системе (адиабатический процесс)
pV g = const .
Здесь g = c p /c V — отношение теплоемкостей газа при постоянном давлении и постоянном объеме (вывод этой формулы не входит в школьную программу).
