Работа и энергия в термодинамической системе. Термодинамическая система может разными способами обмениваться энергией с окружающей средой, поглощая или отдавая количество теплоты и совершая работу. Приняты следующие соглашения: количество теплоты, поступающее в систему, считается положительным ( Q > 0 ); если система отдает количество теплоты окружающей среде, то Q 0 ); если работа совершается внешними источниками над системой, то A < 0 .
Пусть система находится в каком-то термодинамическом состоянии, отвечающем точке 1 на pV-диаграмме. Возможны несколько разных путей (процессов), переводящих систему из состояния 1 в состояние 2 . Важно, что работа, совершаемая системой при переходе 1 (r) 2, зависит от пути, т. е. от конкретных деталей процесса (можно совершить переход изотермически, адиабатически, изобарически, изохорически или путем комбинации всех этих способов, при этом совершаемая работа будет разной. Точно так же будут разными количества теплоты, поступающие в систему или отдаваемые системой при таком переходе. Таким образом, ни работа A , ни количество теплоты Q не являются функциями состояния системы (если бы это было так, то A Q зависели бы только от начального и конечного состояний системы) .
Однако многочисленные эксперименты показывают, что разность Q — A не зависит от характера протекания процесса и определяется только начальным и конечным состояниями системы. Так как эти состояния обладают определенной внутренней энергией U , которая для идеального газа зависит только от температуры, то на основании закона сохранения энергии, обобщенного на случай тепловых явлений, можно записать:
![]()
Первый закон (первое начало) термодинамики : В тепловом процессе, в котором количество теплоты Q поступает в систему и сама система совершает работу A , полная энергия, переданная системе, равна изменению внутренней энергии системы D U .
На самом деле, первый закон термодинамики может быть сформулирован в более общем виде, если иметь в виду эквивалентность всех форм энергии: В любой изолированной системе полная внутренняя энергия неизменна, хотя может переходить из одной формы в другую .
Если на pV -диаграмме отмечены две точки (два состояния) и с помощью любой комбинации тепловых процессов осуществлен переход из состояния 1 в состояние 2, то можно утверждать, что внутренняя энергия системы изменилась на величину U 2 — U 1 . Отсюда следует, что для любого замкнутого цикла, в результате которого система возвращается в исходное состояние, изменение внутренней энергии равно нулю. Но это не означает, что в замкнутом цикле не совершается работа или не поглощается (выделяется) количество теплоты. Выражая закон сохранения энергии, первый закон термодинамики остается справедливым для любых процессов указанных выше четырех общих типов. Иными словами, в формуле, выражающей содержание первого закона, знаки A Q могут быть разными в зависимости от характера процесса. Соответственно D U может быть как положительной, так и отрицательной величиной.
Изохорический процесс. На каждом шаге квазистатического изохорического процесса объем не меняется, dV = 0 , следовательно, система не совершает работы: dA = pdV = 0 . Поэтому полная работа А также равна нулю и
D U = Q .
Молярная теплоемкость идеального газа при постоянном объеме определяется из соотношения d Q = n c V dT , где — число молей газа. Так как dU = d Q при постоянном объеме, то
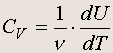
Но U = (3/2) n RT для идеального одноатомного газа, поэтому молярная теплоемкость
идеального одноатомного газа при постоянном объеме равна
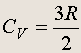 (6.1)
(6.1)
Адиабатический процесс . В таком процессе система не обменивается количеством теплоты с окружающей средой (система теплоизолирована), и на каждом шаге d Q = 0 . Поэтому для всего процесса Q = 0 D U = — A .
Изотермический процесс . В этом процессе температура не меняется, следовательно, не меняется и внутренняя энергия идеального газа: D U = 0 . Отсюда следует, что в изотермическом процессе вся совершаемая идеальным газом (следует учесть, что это очень частный случай) работа равна количеству теплоты, поступившей в систему: A = Q .
Конечно, для реальных газов это утверждение неверно.
Изобарический процесс. Так как давление постоянно, то работа в этом случае равна произведению постоянного давления на величину изменения объема: A = p(V 2 — V 1 ) .
