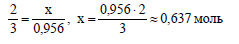Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №4 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №4 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома».
|
Условие задачи: На 18 г технического алюминия подействовали избытком раствора гидроксида натрия. При этом выделилось 21,4 л газа (н. у.).
Определите процентное содержание примесей в техническом алюминии, если известно, что в нем не содержалось других веществ, способных реагировать с гидроксидом натрия.
Решение:
2Аl + 2NaOH + 6Н2O = 2Na[Al(OH)4] + 3Н2
Вычислим количество вещества выделившегося водорода:
По уравнению реакции при взаимодействии 2 моль алюминия со щелочью выделяется 3 моль водорода. Пусть при выделении 0,956 моль водорода в реакцию вступило х моль алюминия. Составим пропорцию:
Молярная масса алюминия равна 27 г/моль. Вычислим массу прореагировавшего алюминия:
m(Al) = ?(Al) · M(Al) = 27 моль · 0,637 г/моль = 17,2 г.
Масса примесей равна 18 г – 17,2 г = 0,8 г. Массовая доля примесей равна 0,8/18 = 0,044, или 4,4%.
Ответ: в техническом алюминии содержится 4,4% примесей.