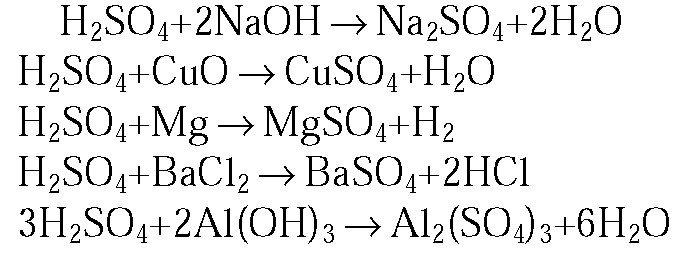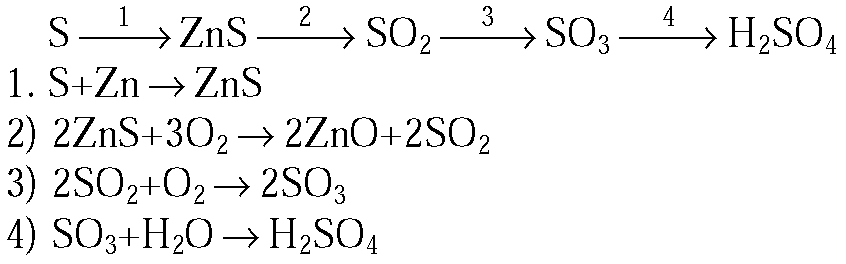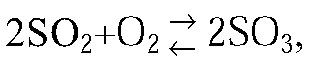Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №3 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 3. Итоговая по теме II». Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №3 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 3. Итоговая по теме II».
|
Условие задачи: Вариант 3
Вопросы:
1. С какими из перечисленных веществ будет реагировать раствор серной кислоты: гидроксид натрия, оксид меди(II), золото, магний, хлорид бария, серебро, гидроксид алюминия? Напишите уравнения осуществимых реакций (два из них в ионной форме).
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
S →1→ ZnS →2→ SO2 →3→ H2SO3 →4→ K2SO3
3. Как зависит скорость химических реакций: а) от катализатора; б) от природы реагирующих веществ? Приведите примеры.
4. Для сжигания 9,6 г серы израсходовали 28 л воздуха, обогащенного кислородом. Рассчитайте объемную долю кислорода в этом воздухе. (Ответ: 24%.)
Ответы и решения:
1.
2.
3. а) При правильном подборе катализатора скорость реакции значительно возрастает.
б) Разные вещества реагируют с одним и тем же веществом с разной скоростью.
Примеры см. Тема II, работа 2, вариант 1, 4, вопрос 1.
4. Примеси, содержащиеся в сернистом газе, могут являться
ингибиторами реакции
при этом значительно
снижается ее скорость.