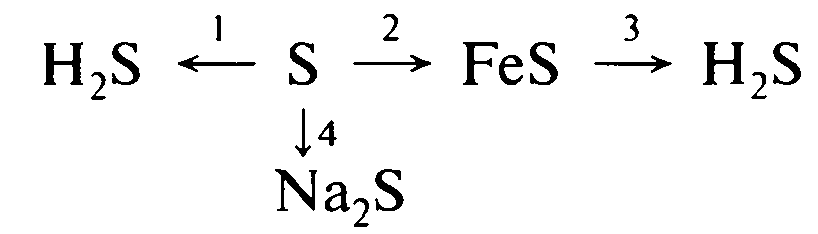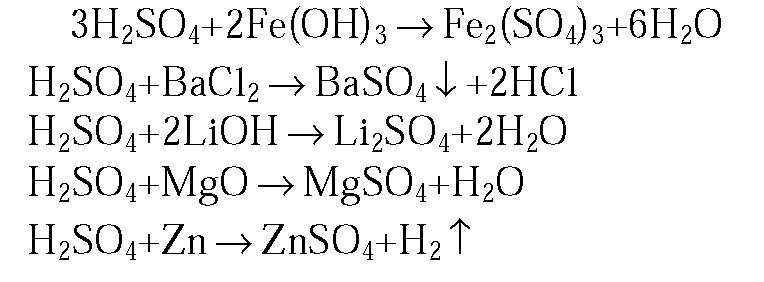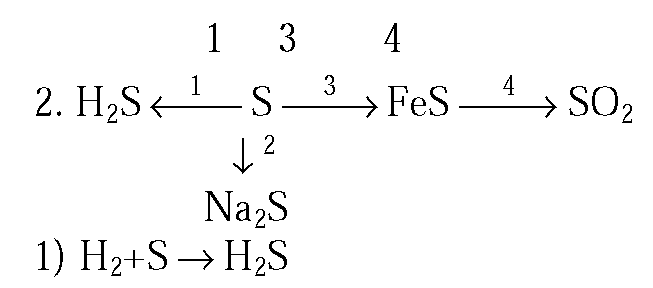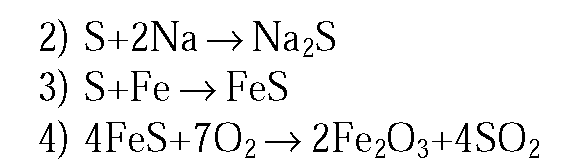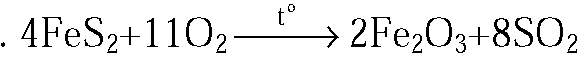Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 3. Итоговая по теме II». Решебник по химии за 9 класс (А. М.Радецкий, 2011 год), №2 к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 3. Итоговая по теме II».
|
Условие задачи: Вариант 2
Вопросы:
1. С какими из перечисленных веществ будет реагировать раствор серной кислоты: ртуть, гидроксид железа(III), хлорид бария, гидроксид лития, оксид магния, цинк, оксид углерода(IV)? Напишите уравнения осуществимых реакций (два из них в ионной форме).
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. Как зависит скорость химических реакций: а) от температуры; б) от концентрации реагирующих веществ? Приведите примеры.
4. Рассчитайте объем воздуха (н. у.), который расходуется при полном сгорании 12,8 г серы. Объемная доля кислорода в воздухе составляет 21%. (Ответ: 42,67 л.)
Ответы и решения:
1.
3. а) при увеличении температуры, скорость реакции увеличивается;
б) при увеличении концентрации исходных веществ, скорость реакции увеличивается. Примеры см. тема II, работа 2, вариант 2, 3, вопрос 1.
4
Этот процесс основан на применении принципа теплообмена, при этом достигается максимальный выход продукта.