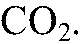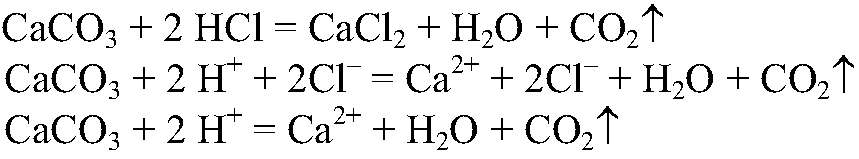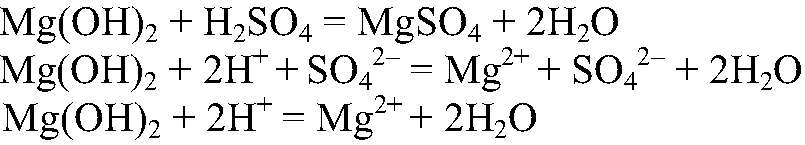Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы».
|
Условие задачи: Практическая работа № 6 стр. 139 Решение экспериментальных задач
А) Различить вещества: CaCl2, NaOH, K2CO3, BaCl2
1) Действия: Добавляем раствор кислоты
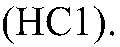
Наблюдения: В одной из пробирок выделяется газ. Уравнения реакции:
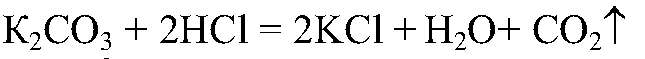
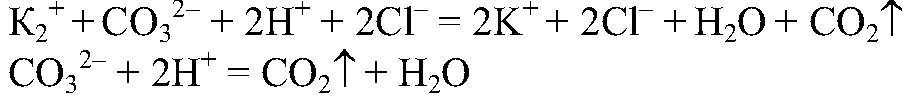
Выводы: Проведенная реакция является качественной на карбонат-ион, следовательно в данной пробирке находится карбонат калия. 2) Действия: Добавляем фенолфталеин. Наблюдения: В одной из пробирок р-р окрасился в розовый цвет.
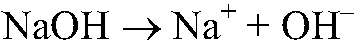
Выводы: В данной пробирке — гидроксид натрия, т. к. розовеет фенолфталеин в щелочной среде. 3) Действия: Добавляем раствор сульфата натрия. Наблюдения: В одном случае образуется белый осадок, а в другом происходит только помутнение раствора. Уравнения реакции:
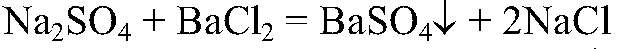
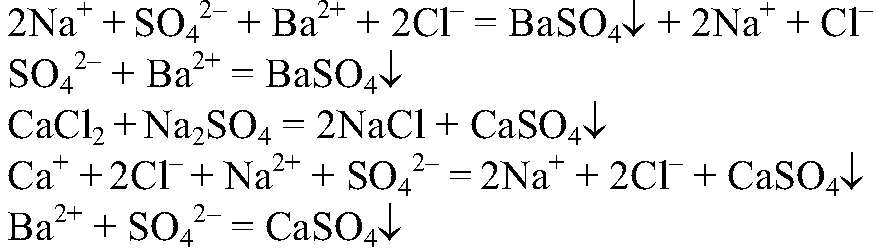
Выводы: Сульфат кальция — малорастворимым, сульфат бария является нерастворимым соединением, Значит, там, где помутнение раствор — хлорид кальция, где образовался белый осадок, был хлорид бария.
Б) Различить вещества: CaCO3, Ba(NO3)2, Na2SO4
1) Действия: Добавляем соляную кислоту. Наблюдения: В одной из пробирок выделяется газ. Уравнения реакции:
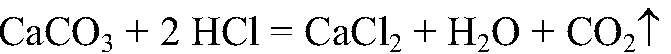
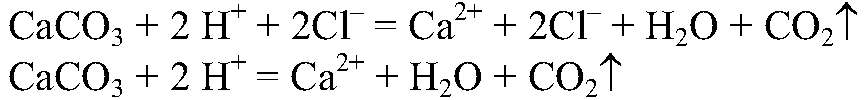
Выводы: Эта реакция является качественной на карбонат-ион, поэтому в данной пробирке находится карбонат кальция. 2) Действия: Оставшиеся вещества разбавляем водой и добавляем раствор сульфата натрия. Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:
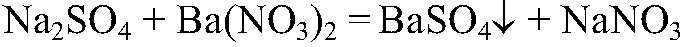
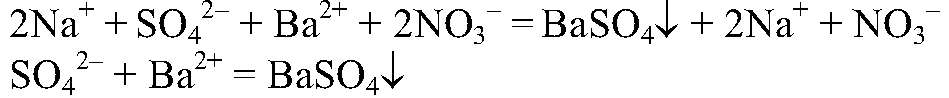
Выводы: В данной пробирке содержится нитрат бария, т. к. данная реакция является качественной на ион
3) Действия: К оставшимся растворам добавляем раствор нитрата бария. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции:
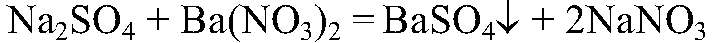
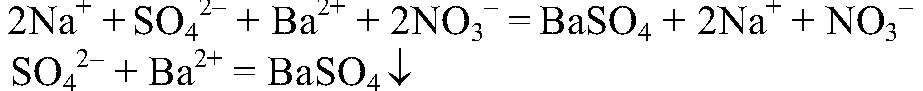
Выводы: Реакция является качественной на сульфат-ион, поэтому в данной пробирке находится сульфат натрия. 4) Действия: К оставшемуся раствору добавляем раствор нитрата серебра (I). Наблюдения: Образовался белый осадок. Уравнения реакции:
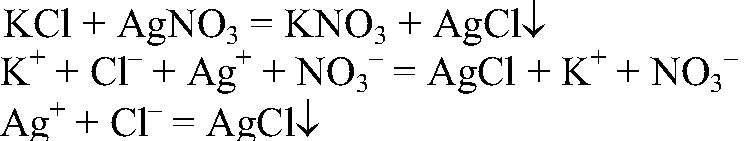
Выводы: Реакция является качественной на хлорид-ион, поэтому в данной пробирке находится хлорид калия.
В) Осуществить превращение: CaCL2 → Ca(OH)2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CaCl2
1) Действия: К концентрированному раствору хлорида кальция добавляем концентрированный раствор щелочи. Что происходит:
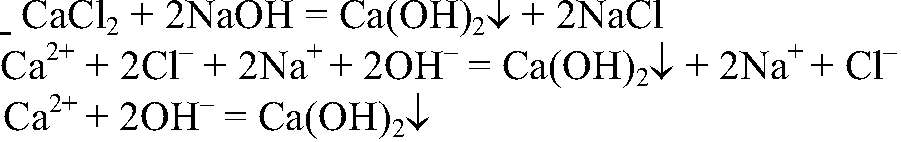
2) Действия: Через получившуюся взвесь пропускаем
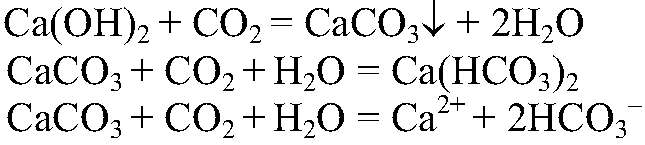
3) Действия: Нагреваем получившийся раствор. Что происходит:
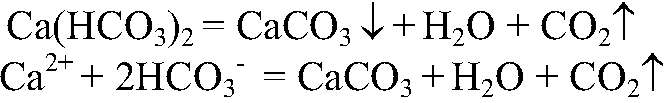
4) Действия: Добавляем соляную кислоту. Что происходит:
Г) Осуществить превращение: MgCO3 → MgCl2 → Mg(OH)2 → MgSO4
1) Действия:
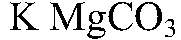
добавляем соляную кислоту. Что происходит:
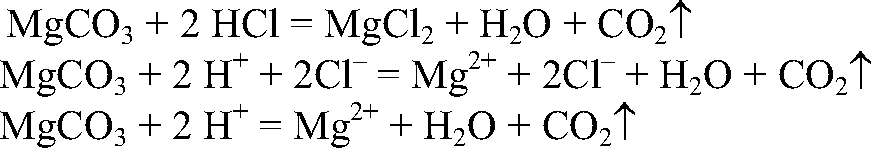
2) Действия: Добавляем раствор щелочи. Что происходит:
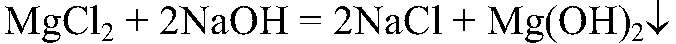
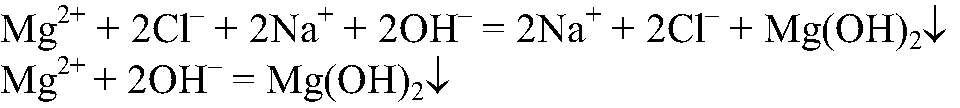
3) Действия: Добавляем раствор серной кислоты. Что происходит: