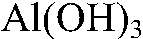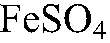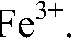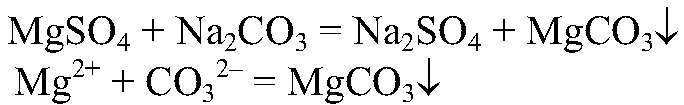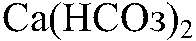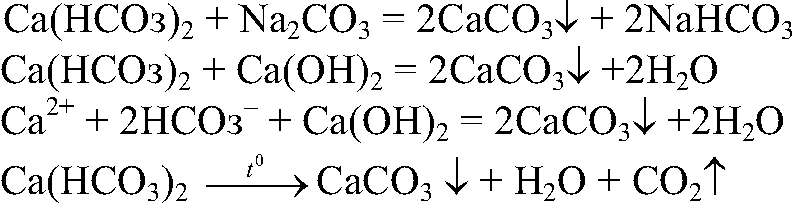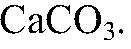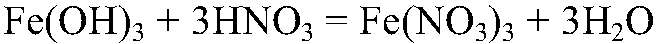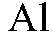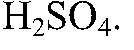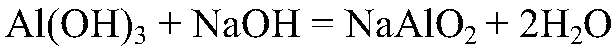Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы».
|
Условие задачи: Практическая работа № 8 стр. 145 Решение экспериментальных задач
1) Различить вещества: а) MgCl2; б) NaOH; в) Na2CO3; г) NaNO3;
а) Действия: Ко всем веществам добавляем р-р соляной кислоты. Наблюдения: В одной из пробирок выделяется газ. Уравнения реакции:
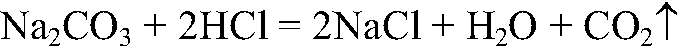
Выводы: В данной пробирке содержится карбонат натрия, т. к. протекает качественная реакция на карбонат-ион. б) Действия: Оставшиеся вещества растворяем в воде и к полученным растворам добавляем фенолфталеин. Наблюдения: В одной из пробирок раствор розовеет. Уравнения реакции:
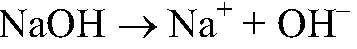
Выводы: Раствор фенолфталеина розовеет в щелочной среде (под действиям ионов OH — ), поэтому в данной пробирке находится гидроксид натрия. в) Действия: К оставшимся растворам добавляем раствор нитрата серебра (I). Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:
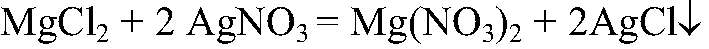
Выводы: Эта реакция качественная на хлорид-ион, значит, в данной пробирке находится хлорид магния. г) Действия: К оставшемуся раствору добавляем концентрированную серную кислоту и кусочек меди. Нагреваем. Наблюдения: Выделяется газ бурого цвета, медь растворяется, а раствор становится голубого цвета. Уравнения реакции:
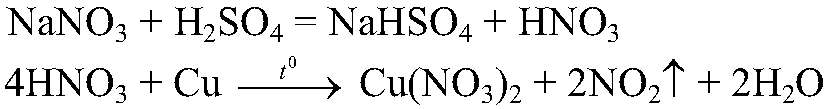
Выводы: Реакция является качественной на нитрат-ион, следовательно, в данной пробирке находится нитрат натрия.
2) Различить вещества: а) CaCO3; б) Ba(NO3)2; в) Na2SO4; г) Na2S
а) Действия: Ко всем веществам добавляем р-р соляной кислоты. Наблюдения: В одной из пробирок выделяется газ без запаха, а в другой — с неприятным запахом. Уравнения реакции:
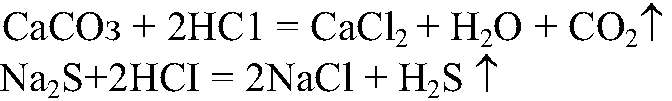
Выводы: В пробирке, в которой выделялся газ без запаха, содержится
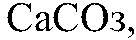
т. к. это качественная реакция на карбонат-ион. Там, где выделялся газ с неприятным запахом
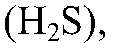
содержится сульфид натрия. б) Действия: После растворения оставшихся веществ в воде добавляем раствор сульфата натрия. Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:
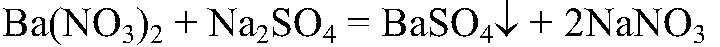
Выводы: Качественная реакция на ион бария, значит, в данной пробирке — нитрат бария. в) Действия: К оставшемуся р-ру добавляем р-р хлорида бария. Наблюдения: Образовался белый осадок. Уравнения реакции:
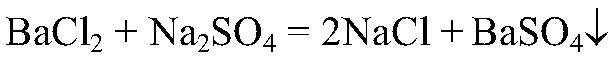
Выводы: Это качественная реакция на сульфат-ион, следовательно, в данной пробирке — сульфат натрия.
3) Доказать, что выданное вещество — сульфат алюминия Al2(SO4)3
а) Действия: К выданному в-ву добавляем раствор хлорида бария. Наблюдения: Выпал белый осадок. Уравнения реакции:
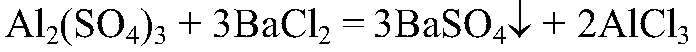
Выводы: Это качественная реакция на сульфат-ион. б) Действия: К небольшому количеству раствора щелочи добавляем раствор выданного вещества. Наблюдения: Образовался белый студенистый осадок. Уравнения реакции:
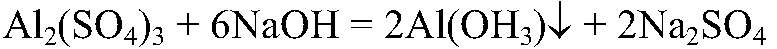
Выводы: В результате происходит образование нерастворимого основания
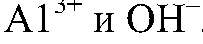
Значит, в исследуемом веществе содержится ион алюминия. в) Действия: Добавляем избыток щелочи. Наблюдения: В избытке щелочи осадок растворяется. Уравнения реакции:
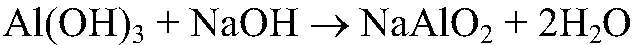
Выводы: Гидроксид обладает амфотерными свойствами: образуется матааллюминат натрия. Это еще раз доказывает, что выданное вещество содержит ион алюминия.
4) Различить растворы: NaCL, BaCl2, AlCl3
а) Действия: Ко всем растворам добавляем р-р сульфата натрия. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции:
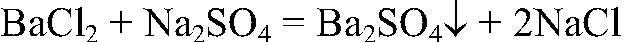
Выводы: В данной пробирке содержится хлорид бария, т. к. эта реакция — качественная на ионы бария. б) Действия: К двум оставшимся растворам добавляем немного раствора щелочи. Наблюдения: В одной из пробирок образовался белый студенистый осадок. Уравнения реакции:
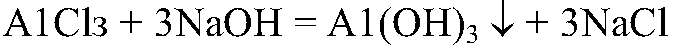
Выводы: В данной пробирке — хлорид алюминия. в) Действия: Несколько капель оставшегося раствора вносим в пламя спиртовки на нихромовой проволоке. Наблюдения: Пламя окрашивается в желтый цвет. Выводы: В данной пробирке — хлорид натрия, т. к. в желтый цвет пламя окрашивают ионы натрия.
5) Доказать, что кристаллы FeSO4 частично окислились и содержат примеси ионов Fe3+
Действия: Растворяем кристаллы в воде и добавляем р-р
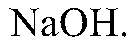
Наблюдения: Образуется зеленый и бурый осадки. Уравнения реакции:
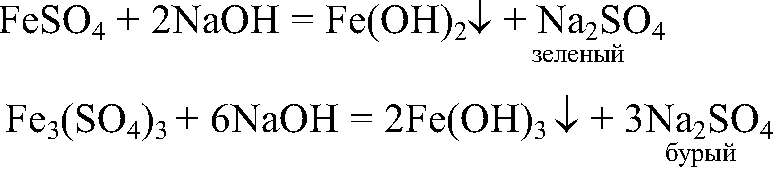
Выводы: Бурый осадок — нерастворимое основание
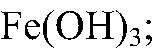
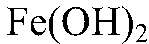
имеет зеленый цвет. Значит, в исходном
6) В двух склянках дана вода. В одной из них вода содержит MgSO4, а в другой — Ca(HCO3)2. Проделать опыты, при помощи которых можно устранить постоянную и временную жесткость.
а) Действия: В воду, содержащую
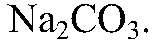
Наблюдения: Образуется белый осадок. Уравнения реакции:
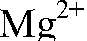
обуславливают постоянную жесткость воды. Такую воду можно умягчить, добавив раствор карбоната натрия, т. к. при этом происходит связывание ионов
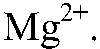
б)Действия: В воду, содержащую
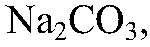
известковое молоко, т. е. насыщенный раствор
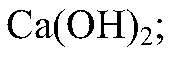
кипятим ее. Наблюдения: Образуется белый осадок. Уравнения реакции:
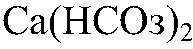
обуславливает временную жесткость воды. Эту воду можно умягчить добавлением известкового молока, соды или кипячением, т. к. все эти процессы сопровождаются образованием
7) Осуществить превращения:
а) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe(NO3)3
1. Действия: К порошку железа добавляем соляную кислоту. Уравнения реакции:
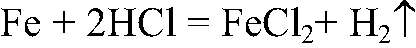
2. Действия: После прекращения выделения газа добавляем раствор щелочи. Уравнения реакции:
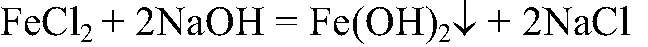
3. Действия: К осадку добавляем немного р-ра перекиси водорода. Уравнения реакции:
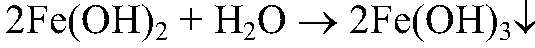
4. Действия: К осадку добавляем раствор азотной кислоты Уравнения реакции:
б) Al → Al(SO4)3 → Al(OH)3 → NaAlO2
1. Действия: К нескольким гранулам
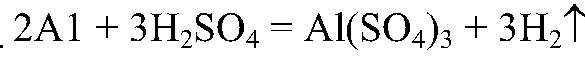
2. Действия: После выделения газа добавляем щелочь (по каплям). Уравнения реакции:
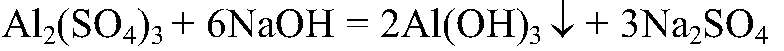
3. Действия: К осадку добавляем избыток щелочи. Уравнения реакции: