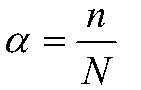Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №11 к главе «Глава I §§ 1-3 стр. 12». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №11 к главе «Глава I §§ 1-3 стр. 12».
|
Условие задачи: Вопрос № 12 Приведите примеры сильных и слабых электролитов. Где на практике необходимо учитывать силу электролитов?
Ответ: Сильные электролиты — практически все растворимые в воде соли, кислоты
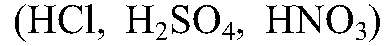 щелочи, гидроксиды бария и кальция. Слабые электролиты — некоторые кислоты
щелочи, гидроксиды бария и кальция. Слабые электролиты — некоторые кислоты
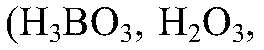
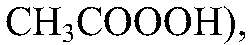 вода. Сила электролита характеризуется степенью диссоциации — отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе:
вода. Сила электролита характеризуется степенью диссоциации — отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе:
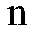 — число диссоциированных молекул;
— число диссоциированных молекул;
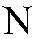 — общее число растворенных молекул. Для сильных электролитов
— общее число растворенных молекул. Для сильных электролитов
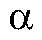 близка к 1. В зависимости от электролитов
близка к 1. В зависимости от электролитов
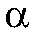 может меняться от 0 (диссоциации нет) до 1 (полная диссоциация).
может меняться от 0 (диссоциации нет) до 1 (полная диссоциация).