 Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №3 к главе «Глава III §§ 14 -16 стр. 43». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №3 к главе «Глава III §§ 14 -16 стр. 43».
|
Условие задачи: Вопрос № 3 В таблице 11 (стр.34) указаны условия, влияющие на скорость химических реакций, и даны примеры. Назовите для каждого условия один-два дополнительных примера, составьте уравнения реакций и дайте обоснование их осуществления.
Ответ: 1) Скорость химических реакций зависит от природы реагирующих веществ.
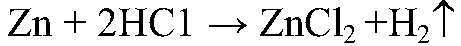 — скорость реакции высокая, т. к. соляная кислота обладает высокой химической активностью.
— скорость реакции высокая, т. к. соляная кислота обладает высокой химической активностью.
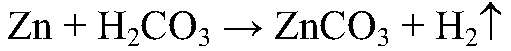 — скорость реакции низкая, т. к. угольная кислота очень слабая. 2 ) Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ.
— скорость реакции низкая, т. к. угольная кислота очень слабая. 2 ) Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ.
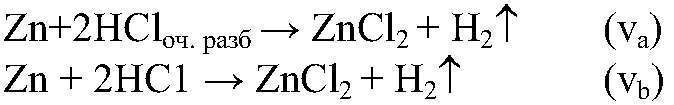
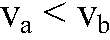 это можно наблюдать по скорости выделения газа. 3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
это можно наблюдать по скорости выделения газа. 3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
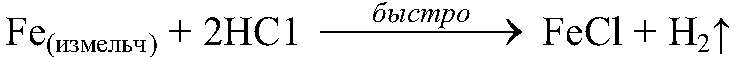 — эта реакция идет очень интенсивно, если использовать железный порошок. 4) При повышении температуры реакции на каждые 10
— эта реакция идет очень интенсивно, если использовать железный порошок. 4) При повышении температуры реакции на каждые 10
 скорость большинства реакций увеличивается в 2-4 раза.
скорость большинства реакций увеличивается в 2-4 раза.
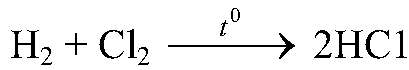 — при обычных условиях реакция идет очень медленно, но при нагревании происходит взрыв.
— при обычных условиях реакция идет очень медленно, но при нагревании происходит взрыв.
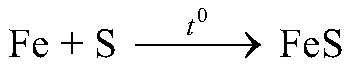 — эта реакция без нагревания почти не идет, при нагревании сульфид железа образуется достаточно быстро. 5) Скорость химических реакций зависит от присутствия некоторых веществ (катализаторов):
— эта реакция без нагревания почти не идет, при нагревании сульфид железа образуется достаточно быстро. 5) Скорость химических реакций зависит от присутствия некоторых веществ (катализаторов):
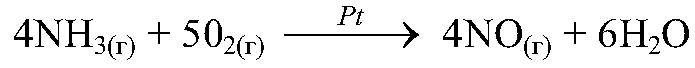 — эта реакция идет достаточно быстро только в присутствии катализатора — раскаленной платиновой проволоки, она остается в состоянии красного каления в растворе аммиака вплоть до окончания реакции.
— эта реакция идет достаточно быстро только в присутствии катализатора — раскаленной платиновой проволоки, она остается в состоянии красного каления в растворе аммиака вплоть до окончания реакции.
