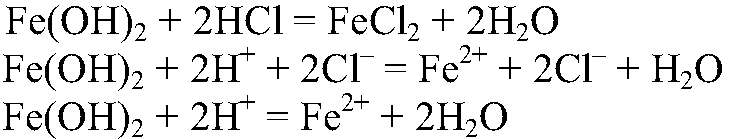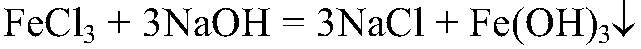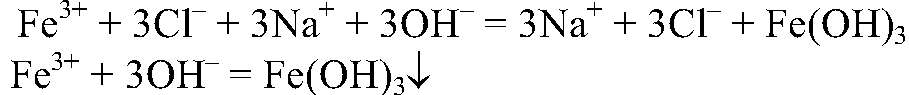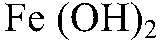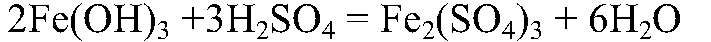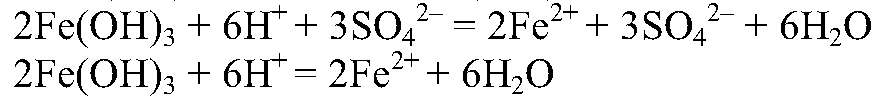Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы». Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №0 к главе «Лабораторные и практические работы».
|
Условие задачи: Практическая работа № 7 стр. 144 Решение экспериментальных задач
Сжигание железа в кислороде и хлоре.
1. Кислород окисляет железо, при этом происходит образование железной окалины — смешанного оксида
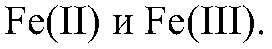
Хлор является сильным окислителем, поэтому окисляет железо до более высокой степени окисления (+3), при этом образуется хлорид желез (III). 2. Кислород и хлор — окислители, железо — восстановитель.
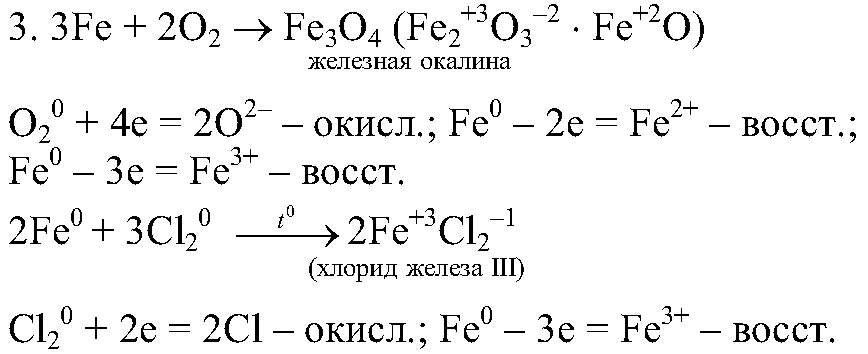
Взаимодействие железа с концентрированными кислотами 1. Азотная и концентрированная серная кислоты относятся к ки-слотам-окислителям, т. е. они проявляют сильные окислительные свойств за счет кислотного остатка. Выделяющийся при восстановлении азотной кислоты оксид азота(II) легко окисляется кислородом воздух до оксида азота (IV).
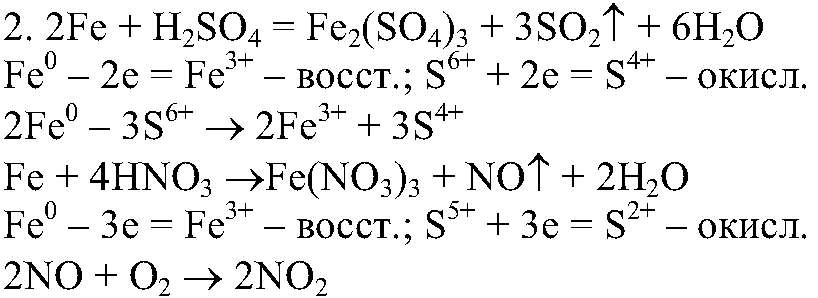
Примечание: с концентрированной азотной кислотой и концентри-рованной серной на холоду железо не реагирует (пассивируется).
Получение гидроксида железа (II) и взаимодействия его с кислотами
а) Действия: К свежеприготовленному раствору сульфата железа (II) добавляем раствор гидроксида натрия. Наблюдения: Образуется осадок зеленоватого цвета. Уравнения реакции:
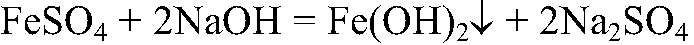
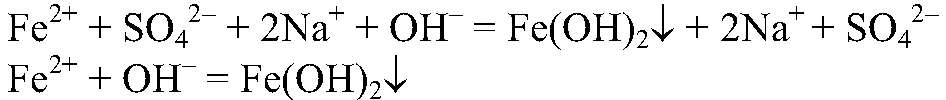
Выводы: Гидроксиды железа (II) и (III) можно получить в резуль-тате реакции обмена между растворимыми солями желез (II) и (III) раствором щелочи, т. к. в этом случае происходит связывание ионов:
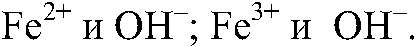
б) Действия: К осадку добавляем раствор соляной кислоты. Наблюдения: Осадок растворяется. Уравнения реакции:
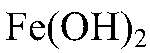
имеет основной характер, поэтому он реагирует с кислотами.
Получение солей гидроксида железа (III) и взаимодействия его с кислотами с образованием соответствующих солей
а) Действия: К р-ру хлорида железа (III) добавляем р-р щелочи. Наблюдения: Выпадает осадок бурого цвета. Уравнения реакции:
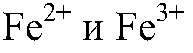
можно определить с помощью реакции между их солями и щелочью, т. к. в этом случае образуются осадки:
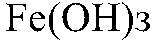
— бурый. б) Действия: К осадку добавляем серную кислоту. Наблюдения: Осадок растворяется. Уравнения реакции: