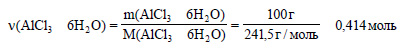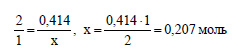Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №3 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома». Решебник по химии за 11 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 2000 год), №3 к главе «Глава II. Периодический закон и периодическая система Д. И. Менделеева на основе учения о строении атома».
|
Условие задачи: Сколько оксида алюминия в граммах можно получить из 100 г кристаллогидрата хлорида алюминия АlCl3 ? 6Н2О?
Решение:
При взаимодействии хлорида алюминия с гидроксидом натрия образуется гидроксид алюминия:
АlCl3 + 3NaOH = Аl(ОН)3 + 3NaСl (1)
При прокаливании гидроксид алюминия разлагается с образованием оксида алюминия.
2Аl(ОН)3 = Аl2О3 + 3Н2О (2)
Вычислим молярную массу кристаллогидрата хлорида алюминия:
М(АlCl3 ? 6Н2O) = 27 + 35,5 ? 3 + 6 ? (1 ? 2 + 16) = 241,5 г/моль
Вычислим количество вещества кристаллогидрата хлорида алюминия:
Количество вещества хлорида алюминия, очевидно, равно количеству вещества кристаллогидрата. По уравнению (1) из 1 моль хлорида алюминия можно получить 1 моль гидроксида алюминия. По уравнению (2) из 2 моль гидроксида алюминия получится 1 моль оксида алюминия. Значит, для получения 1 моль оксида алюминия нужно 2 моль хлорида алюминия. Пусть из 0,414 моль хлорида алюминия получится х моль оксида алюминия. Составим пропорцию:
Вычислим молярную массу оксида алюминия:
М(Аl2О3) = 27 · 2 + 16 · 3 = 102 г/моль
Вычислим массу оксида алюминия:
m(Аl2О3) = ?( Аl2О3) · М(Аl2О3) = 0,207 моль · 102 г/моль? 21,1 г.
Ответ: можно получить 21,1 г оксида алюминия.